Entropia
Analisando a entropia
Energia livre de Gibbs
Analisando a espontaneidade
Exemplo
Aplicação na eletroquímica
Entropia
A Entropia representa o grau de desordem de um sistema, e é representado pela letra S. Quanto maior
for o grau de desordem de um sistema, maior será a entropia sua entropia.
Um exemplo simples para entender a desordem das moléculas em um sistema é o gelo que derrete. As
moléculas no estado sólido estão mais próximas e têm menor possibilidade de movimentação, portanto elas
estão mais organizadas.
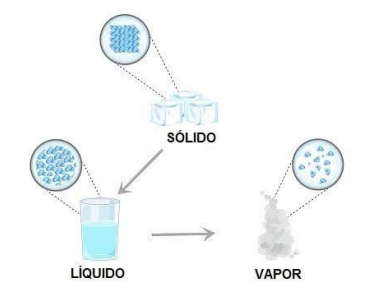
Com mudança para o estado líquido, as moléculas irão ganhar cada vez mais liberdade para se
movimentar e com isso se tornarão cada vez mais desorganizadas, tendo assim um aumento na sua entropia.
A tendência natural dos sistemas é de aumentar a desordem das moléculas, o que significa um aumento
da entropia. Podemos dizer então que nos sistemas: ΔS >0(variação da entropia), onde S é entropia.
Calcular a desordem de um sistema pelo cálculo da variação da entropia é algo matematicamente
simples, basta utilizar a seguinte fórmula:
ΔS = Sp - Sr
ΔS = variação da entropia de um sistema;
Sp = entropia dos produtos;
Sr = entropia dos reagentes;
Obs.: utilizaremos como unidade de medida cal/K.mol ou cal.mol-1.K-12
Química
Energia livre de Gibbs
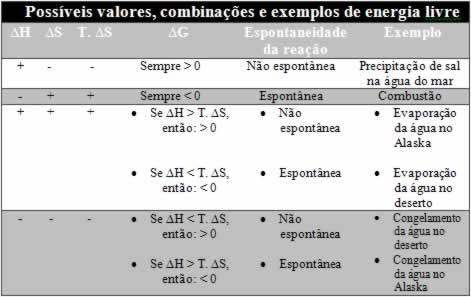
Um processo químico pode ser identificado como espontâneo ou não a partir da variação da energia
livre de Gibbs, representada por ΔG.
A pressão e temperatura constantes, a energia livre de Gibbs pode ser obtida por:
ΔG=ΔH−TΔS
ΔS = variação da entropia de um sistema
ΔG = variação da energia livre de Gibbs de um sistema
ΔH = variação da entalpia de um sistema
T = temperatura em kelvin
Quando o valor de ΔG for menor do que zero, a reação ocorre de forma espontânea.
Quando o valor de ΔG for maior do que zero, a reação NÃO ocorre de forma espontânea.