Definindo um eletrodo
Eletrodos ativos
Eletrólise de H2SO4 aquoso com eletrodo de Cobre
Eletrólise de CuSO4 aquoso com eletrodo de Cobre impuro
Eletrólise de NiSO4 aquoso com eletrodo de Níquel
Em qualquer eletrólise, os eletrodos devem, evidentemente, ser bons condutores de eletricidade; isso nos obriga a utilizar eletrodos metálicos ou de grafite. Por outro lado, o eletrodo pode sofrer corrosão devido à passagem da corrente elétrica ou devido às substâncias formadas na eletrólise.
O eletrodo de grafite, por exemplo, resiste a quase tudo, exceto ao oxigênio, pois, sendo uma
variedade de carbono, ele sofre oxidação na presença de oxigênio:
C (grafite) + O2 → CO2
Os eletrodos metálicos funcionam bem na posição de catodo. Na posição de anodo, porém, o
metal pode ser rapidamente corroído, ou melhor, pode participar da própria eletrólise, uma vez que:
• o anodo é um oxidante poderoso;
• os metais (Me) têm uma tendência natural de perder elétrons (oxidação):
Me → Me+ + e-
Chega-se então a uma situação extrema, na qual o anodo ou polo positivo “prefere” retirar
elétrons do próprio metal que o constitui, em vez de descarregar os ânions existentes em solução;
desse modo, o próprio anodo vai sendo desgastado ou corroído.
Aliás, essa situação é bastante comum; praticamente todos os metais acima do cobre (E0 = +0,34 V)
na tabela dos potenciais-padrão de eletrodo irão sofrer oxidação eletrolítica se forem colocados como
anodo em uma célula eletrolítica. Nesses casos, diremos que o eletrodo é não inerte ou ativo, uma vez que
ele está tomando parte na reação de eletrólise.
Exemplo — eletrólise de H2SO4 em solução aquosa diluída, com eletrodos de cobre
Na solução aquosa, temos as seguintes ionizações:
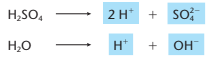
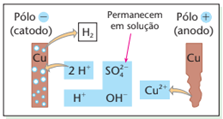
O polo negativo tem como única opção a descarga do H+. Já o polo positivo, poderia optar por tirar elétrons ou do SO42-, ou OH-, ou agora do próprio ânodo (metal cobre). Segundo a equação Cu → Cu2+ + 2 e-. Como essa oxidação é mais fácil, ela será sem dúvidas preferida.
Teremos, então, o esquema:
Reações da eletrólise
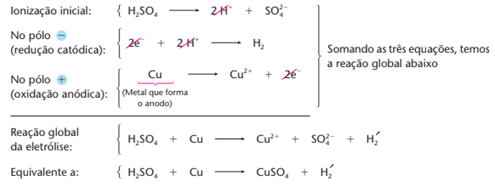
Esquematicamente:
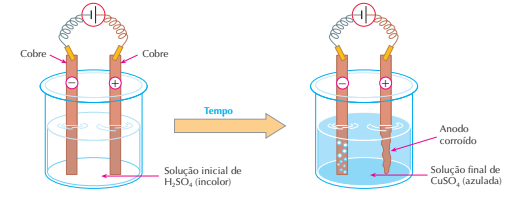
É interessante notar que a reação Cu + H2SO4 → CuSO4 + H2 é espontânea.
O Cu, estando abaixo do H na tabela de potenciais-padrão de eletrodo, não pode deslocar o H+ dos
ácidos; no entanto aqui a reação se efetuou, pois foi forçada a isso pela passagem da corrente elétrica.
Exemplo - eletrólise de CuSO4 em solução aquosa, com anodo de cobre impuro e catodo de cobre puro.
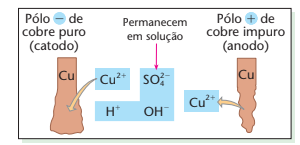
Reações de eletrólise:
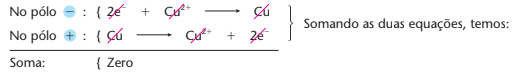
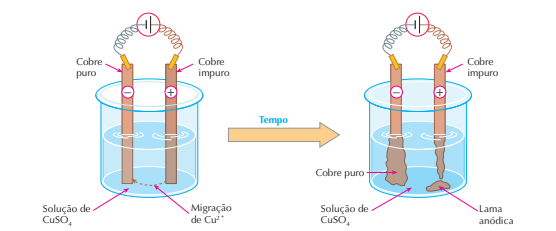
Nesse caso, a corrente elétrica apenas transporta cobre puro do anodo para o catodo; as impurezas existentes no anodo ou ficam em solução, ou precipitam, formando a chamada lama anódica. Esse processo é chamado refino eletrolítico e permite obter cobre com pureza da ordem de 99,9%, que é chamado cobre eletrolítico e é indispensável à fabricação de fios elétricos (as impurezas diminuem exageradamente a condutividade elétrica dos metais). Embora dispendioso, o refino eletrolítico é o melhor método de purificação dos metais. Além do cobre, também o zinco, o chumbo e outros metais são, atualmente, purificados por esse processo.