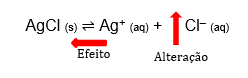Definindo o Kps
Cálculo da solubilidade do composto
Prevendo a precipitação
Efeito do íon comum
Questão sobre Precipitação
Questão sobre Solubilidade do CaCO3
Constante do produto de solubilidade (Kps)
Sabemos que cada composto possui um grau ou coeficiente de solubilidade, que é a relação/divisão entre a quantidade do composto em questão(soluto) e a quantidade de água que formam uma solução saturada desse soluto. Ou seja, se a quantidade de soluto pela quantidade de água de uma solução supera a solubilidade desse composto, a quantidade excedente do mesmo se cristaliza e precipita, formando o precipitado, para evitar que a solução fique supersaturada.
O que vamos estudar aqui é o equilíbrio que se estabelece entre os íons dissociados do soluto e o precipitado (íons não dissociados), atingido quando a velocidade de dissolução se iguala à de precipitação. Acontece assim com o cloreto de sódio, por exemplo:
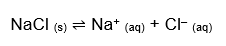
Como todo bom equilíbrio químico, este também tem sua constante, seu padrão que varia com a temperatura: a constante do produto de solubilidade. Para o caso do NaCl, calculamos da seguinte forma:
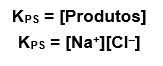
OBS: Sólidos não entram na equação da constante de equilíbrio, lembra disso? Segue a regra. Por isso não temos os reagentes, que nesse caso são sempre sólidos.
Quanto maior o Kps de um são mais é a quantidade de íons dissociados do soluto. Observe o gráfico:
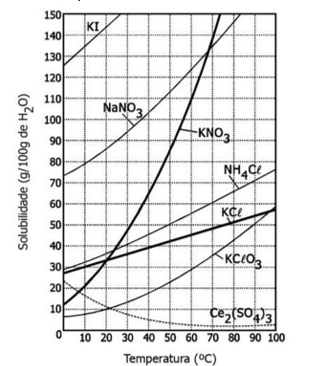
A 50°C o NaNO3 possui o maior Kps, ou seja, ele possui a maior quantidade de íons dissociados em relação ao seu sal que os demais sais do gráfico. Já o Ce2(SO4)3 é o que possui a menor relação.
PSIU! Quem precipita primeira?
No caso da retirada de solvente de uma solução com mais de um sal diferentes entre si, o sal de menor Kps é o primeiro a precipitar.
Solubilidade (S) de um soluto é a concentração dele (geralmente concentração molar) que fica dissociada na solução, que não compõe o precipitado, a determinada temperatura. Logo, as concentrações de Na+ e Cl– que entram na equação do KPS são, cada uma, justamente a solubilidade do NaCl.
Assim, se sabemos o valor de S do NaCl, calculamos o KPS dele assim:
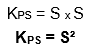
Que tal mais um exemplo para entender 100%? Vamos ao PbCl2. Considerando que a solubilidade dele a 25°C seja S. Qual será o seu KPS, na mesma temperatura?

Efeito do Íon Comum
Ao adicionarmos a uma solução um composto que possua um íon comum ao do soluto preexistente, o equilíbrio se desloca no sentido de consumir esse íon – já que a constante KPS não sofre variação a não ser com mudança de temperatura –, formando mais precipitado, se se tratar de um soluto sólido.
Exemplo: Solução de AgCl em equilíbrio --> adiciono HCl, que se ioniza na solução, gerando íons H+ e Cl– --> a concentração de Cl– aumenta na solução --> equilíbrio se desloca no sentido de consumir o excesso de Cl– --> forma-se mais AgCl puro e sólido.
Observe: