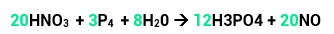Reação Redox - Oxidação, redução, agentes oxidante e redutor
Conceitos de balanceamento Redox
Exemplo 1 - Balanceamento de reação de oxirredução (Mn e Cl)
Exemplo 2 - Balanceamento redox entre Cromo e Carbono
Balanceamento iônico - Redox com cargas explícitas
Exemplo 3 - Reação Auto-Redox
Método da oxidorredução
O método das tentativas em algumas reações redox não é muito prático, veja um passo-a-passo de como equilibrar esse tipo de reação:
1 -Determinar o nox dos elementos na equação;
2 - Identificar os elementos que sofreram oxidação e redução, encontrando a variação de nox de cada um (ex.: se um elemento tinha nox +2 e passou para +4, sua variação será igual a 2).
3 - Multiplicar o valor de cada variação encontrada pelo número de átomos dos elementos que sofreram a variação.
Obs1: Se os valores forem múltiplos (ex.: 9 e 6), devemos simplificá-los (9÷3, 6÷3).
4 - O valor da variação total do elemento que sofreu oxidação deve ser transportado para onde houve redução e vice-versa.
Obs2: A substância que deve receber o coeficiente é aquela que possui o maior número de átomos que efetivamente se oxidaram ou reduziram.
5 - Terminar o balanceamento pelo método da tentativa.
Veja o exemplo:
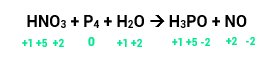
O nox do nitrogênio era +5 e diminuiu para +2, ou seja, ele reduziu e sua variação será de 3.
O nox do fósforo era 0 e aumentou para +5, portanto, ele oxidou. Sua variação será de 5.
Temos 1 átomo de N, então, 1 x 3 = 3 (variação total).
Temos 4 átomos de P, então, 4 x 5 = 20 (variação total).
Agora é só colocar a total do N na frente do P que tiver maior número de átomos e a total do P na frente do N que tiver maior número de átomos (como, neste caso, o N dos reagentes tem o mesmo número do N dos produtos, colocamos o coeficiente na frente dos dois). Teremos, então:
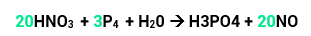
Por fim faremos o balanceamento pelo método das tentativas.Se temos 12 P nos reagentes, devemos ter o mesmo nos produtos. Para isso, vamos colocar 12 na frente do H3PO4. Por fim, ficamos com 68 átomos de O nos produtos, clocando o 8 na frente da água igualamos as quantidades de oxigênio tanto nos produtos quanto nos reagentes. Pronto, sua equação já está balanceada.