Balanceamento por tentativas: Teoria
Balanceamento por tentativas: Exemplos
Balanceamento por Oxi-redução: Teoria
Balanceamento por Oxi-redução-Exemplos
Balanceamento por Oxi-Redução: Íons
Existem alguns métodos modos para se fazer balanceamento de reações, entre eles, o método das tentativas (MACHO) é um dos mais utilizados.
Método das tentativas: Consiste em colocar os coeficientes, ao seu modo, até igualar o número de átomos dos reagentes (lado esquerdo da seta) com os produtos (lado direito da seta). Podemos adotar uma sequência para facilitar a definição dos coeficientes, que chamamos de MACHO:
Metais
Ametais
Carbono
Hidrogênio
Oxigênio
Exemplo: Al(OH)3 + H2SO4 → Al2(SO4)3+ H2O
Ajuste o metal (alumínio)
2Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Ajuste o enxofre (ametal):
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + H2O
Obs: Não temos carbono na reação, então ele será pulado da sequência do MACHO.
Ajuste o hidrogênio:
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
2x3=6 2x3=6 6x2=12
Ajuste o oxigênio:
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
2x3=6 + 3x4=12 = 3x4=12 + 6x1=6
18 = 18
Observe que os oxigênios, por conta da ordem de balanço aplicada, se balancearam automaticamente.
Logo a reação balanceada fica:
2Al(OH)3+ 3H2SO4 → Al2(SO4)3 + 6H2O
E seus coeficientes estequiométricos são → 2:3:1:6
Reações de oxirredução ou redox
Reações de redox, são as que ocorrem com transferência de um ou mais elétrons entre as espécies participantes.
Exemplo: Fe + 2HCl → FeCl2 + H2
Para saber se a reação é de oxirredução basta determinar o nox de cada átomo e verificar se, aos pares, o nox muda.
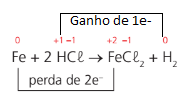
Obs.: O número de elétrons ganhos deverá ser igual ao número de elétrons perdidos.
Oxidação e agente redutor
É o fenômeno da perda de elétrons. A espécie química, ao sofrer oxidação, tende a ceder elétrons, sendo considerado o agente redutor da reação. No nosso exemplo, o agente redutor é o Fe.
Redução ou agente oxidante
É o fenômeno do ganho de elétrons. A espécie química, ao sofrer redução, tende a receber elétrons, sendo considerada o agente oxidante da reação. No nosso exemplo, o agente oxidante é o HCl.
Dica para lembrar:
Quem sofre Oxidação → Perde elétrons → É agente Redutor
Quem sofre Redução → Ganha elétrons → É agente Oxidante