Atomística e número atômico
Número de massa
As cargas dos átomos
Isótopos e isóbaros
Isótonos e isoeletrônicos
Exercício sobre um átomo de cobalto
Exercício sobre dois átomos isóbaros
A estrutura de um átomo é formada pela eletrosfera, onde encontramos os elétrons e pelo núcleo onde encontramos os prótons e nêutrons.
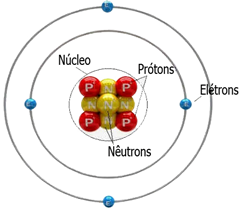
A massa do isótopo de um átomo pode ser encontrada pela soma do número de prótons§ e nêutrons(n). A massa dos elétrons(e-) de um átomo é desprezível pois é muito pequena em relação aos prótons e nêutrons.
O número de massa (A) é a soma de prótons e nêutrons no núcleo de um átomo.
A = p + n
Obs.: A massa atômica(MA) encontrada na tabela periódica é uma média dos isótopos existentes do elemento. Pode ser encontrada por:
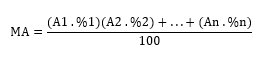
Número Atômico (Z) é o número de prótons presentes no núcleo de um átomo.
Z = p
Quando um átomo está em seu estado fundamental (eletricamente neutro), o seu número de prótons (cargas positivas) é igual ao seu número de elétrons (cargas negativas).
p = e–
Portanto, para um átomo, o número de prótons é também igual ao número de elétrons.
Z = p = e–
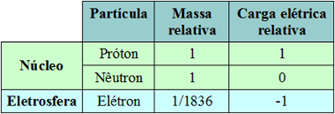
Tais partículas subatômicas possuem cargas características.
Próton: carga positiva
Nêutron: neutro
Elétron: carga negativa
Íons
Quando um átomo eletricamente neutro, ou seja, no estado fundamental perde ou recebe elétrons, ele se transforma em um ÍON.
Quando perde elétrons → íon positivo → Cátion
Quando ganha elétrons → íon negativo → Aniôn
Exemplo:
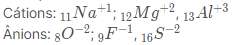
Obs.: Repare que todos os íons dos exemplos acima têm 10 elétrons em sua camada de valência, o que os tornam isoeletronicos.
Obs2.: Íons monovalentes possuem carga +1 ou -1.
Íons bivalentes possuem carga +2 ou -2.
Íons trivalentes possuem carga +3 ou -3.
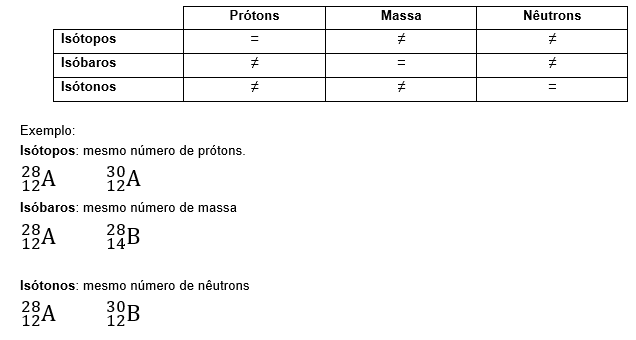
Isótopos, isóbaros, isótonos e isoeletrônicos.
São átomos que possuem o mesmo numero de prótons, de massa e de nêutrons, respectivamente.
Os átomos isoeletrônicos são aquele que possuem o mesmo número de elétrons.
Exemplo: Ca+2 e K+1, ambos possuem 18 elétrons.