O que representa pureza?
Determinação da quantidade produzida utilizando uma amostra impura
Determinação da pureza
Exercício sobre determinação da pureza de uma amostra
Em alguns casos na estequiometria os reagentes da reação apresentam em sua composição impurezas, principalmente em reações industriais, ou porque são mais baratos ou porque já são encontrados na natureza acompanhados de impurezas (o que ocorre, por exemplo, com os minérios). Consideremos o caso do calcário, que é um mineral formado principalmente por CaCO3 (substância principal), porém acompanhado de várias outras substâncias (impurezas). Digamos que tenhamos 100kg do mineral calcário, porém, 90kg são compostos por CaCO3, que é o componente principal desse minério e o que necessariamente vai reagir numa reação química qualquer. Sendo assim, dizemos que 90% de todo minério recolhido é CaCO3, logo, 10kg são apenas impurezas, que, geralmente, não reagem e não entram no cálculo estequiométrico. Com essa análise chegamos à conclusão que essa amostra de minério tem 90% de pureza, ou seja, dos 100kg que nós recolhemos 90kg serão utilizados.
Sendo assim, define-se:
Porcentagem ou grau de pureza é a porcentagem da massa da substância pura em relação à massa total da amostra.
Vejamos um exemplo:
Uma amostra de calcita, contendo 80% de carbonato de cálcio, sofre decomposição quando submetida a aquecimento, segundo a equação abaixo:
CaCO3 --> CaO + CO2
Qual a massa de óxido de cálcio obtida a partir da queima de 800 g de calcita?
Resolução:
O enunciado nos diz que a calcita contém apenas 80% de CaCO3. Temos então o seguinte cálculo de porcentagem:
1ª linha) 800 g de calcita _________ 100%
2ª linha) x g de CaCO3 _________ 80% de --> Grau de pureza
X = 640 g de CaCO3 puro
Note que é apenas essa massa (640g de CaCO3 puro) que irá participar da reação. Assim, teremos o seguinte cálculo estequiométrico:
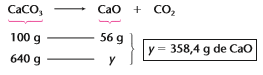
Exemplo 2:
Deseja-se obter 180 L de dióxido de carbono, medidos nas condições normais de temperatura e pressão, pela calcinação de um calcário com 90% de pureza de CaCO3 (massas atômicas: C = 12; O = 16; Ca = 40). Qual é a massa de calcário necessária?
CaCO3 --> CaO + CO2
Resolução:
Esta questão é do “tipo inverso” da anterior. Na anterior era dada a quantidade do reagente impuro e pedida a quantidade do produto obtido, agora é dada a quantidade do produto que se deseja obter e pedida a quantidade do reagente impuro que será necessária. Pelo cálculo estequiométrico normal, teremos sempre quantidades de substâncias puras:
CaCO_3 --> CaO + CO2
100 g ____ 22,4 L (CNTP)
x ____ 180 L (CNTP)
x = 803,57 g de CaCO3 puro
A seguir, um cálculo de porcentagem nos dará a massa de calcário impuro que foi pedida no problema:
803,57g CaCO3 puro ________ 90%
X g ________ 100%
x = 892,85 g de calcário impuro
Note que a massa obtida (892,85g) é forçosamente maior que a massa de CaCO3 puro (803,57g) obtida no cálculo estequiométrico, pois na massa do minério encontrada está contida as impurezas.