Introdução
Polímeros de adição
Polímeros condensação
Compostos iônicos, moleculares e metálicos
Ligações intermoleculares
Exercícios: polímeros
Exercícios: ligações químicas
Do que são feitas as coisas?
I. Polímeros
Os polímeros (do grego: ‘poli’ = muitos; ‘mero’= parte) são macromoléculas em cadeia formadas pela união de estruturas químicas repetidas, os monômeros. Se forem formados por um único tipo de monômeros, chamam-se homopolímero. Caso estejam presentes mais de um tipo de monômero, são chamados copolímeros.

Os principais tipos de copolímeros são:
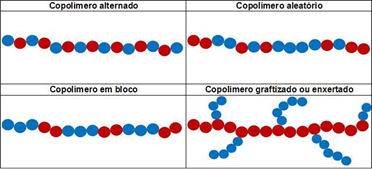
Representação química
Devido à inconveniência de representar estruturas tão grandes por extenso, desenvolveu-se a seguinte representação para cadeias poliméricas:
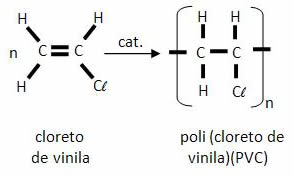
Entre parênteses encontra-se a estrutura química que se repete ao longo da cadeia, com um índice n representando a repetição desta parte, um número indeterminado de vezes. É importante perceber que a estrutura do monômero (molécula que reage para formar a cadeia) é diferente da do polímero: no exemplo acima, a ligação dupla entre os carbonos do cloreto de vinila dá lugar às ligações simples que se formam entre os monômeros no PVC.
Polímeros naturais e sintéticos
Polímeros são frequentemente encontrados na natureza. Exemplos de polímeros naturais são os polissacarídeos (polímeros de açúcares, como celulose e amido), cadeias polipeptídicas (cadeias de aminoácidos, como proteínas e enzimas) e ácidos nucleicos (cadeias de nucleotídeos).
Entre os polímeros sintéticos estão o polietileno, policloreto de vinila (PVC), polipropileno (PP), poliamida (náilon), etc.
Reações de polimerização
A produção de polímeros sintéticos se dá pelas reações de polimerização – as reações que formam ligações entre os monômeros para propagar a cadeia polimérica – que se classificam em reações de adição (poliadição) ou condensação (policondensação).
- Poliadição
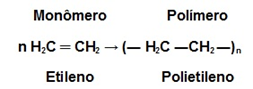
Ocorre a quebra de ligações duplas dos monômeros em uma reação rápida e exotérmica, geralmente catalisada por metais como a platina. É o principal processo de obtenção de plásticos como polietileno, PP, PVC, politetrafluoretileno (PTFE – teflon) e poliestireno (isopor). Estes materiais são chamados polímeros de adição.
O Poliestireno forma a sacola plástica
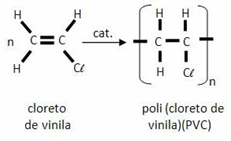

PVC – policloreto de vinila – forma canos de PVC para a construção
- Policondensação
A extensão da cadeia ocorre através de reações de condensação de grupos funcionais (reações com formação de ligação entre duas moléculas, com perda de uma molécula pequena, geralmente água), como aminas, álcoois e ácidos carboxílicos. Esta reação é tipicamente mais lenta que a poliadição. Entre os polímeros produzidos desta forma estão: poliésteres (PET, dácron, terilene), poliamidas (nylon), silicones e policarbonato. Estes são chamados polímeros de condensação.
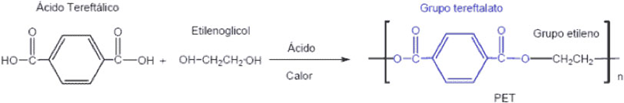

PET – utilizado para fabricação de garrafas
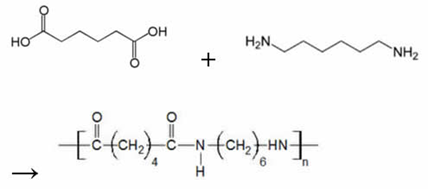
Nylon é uma poliamida
Polímeros termoplásticos e termofixos
- Termoplásticos: Polimeros remodeláveis, por exemplo: Polietileno, Poliamidas, Policarbonato e Poliestireno.
- Termofixos ( termoestáveis): Não são remodeláveis, isto é, seu formato não pode ser modificado com o calor. Exemplo: Resina epóxi, Poliuretano e baquelite. A baquelite é empregada na fabricação de cabos de panelas, já que não derrete sob ação do calor.
Vulcanização
Existem tratamentos químicos para enrijecer as estruturas poliméricas como a vulcanização. Este processo consiste no aquecimento de borrachas ou outros polímeros similares na presença de enxofre. São formadas ligações cruzadas entre as cadeias, alterando as propriedades mecânicas do polímero para o fim desejado.
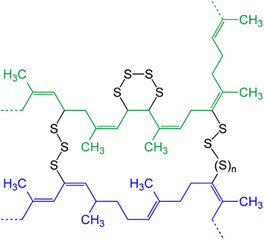
esquema de borracha vulcanizada, com ligações de enxofre entre as cadeias
II. Ligações químicas: iônica, covalente e metálica
Regra do octeto
Os átomos não ficam ‘sozinhos’ na natureza, mas ligados, porque não são estáveis. Tal instabilidade, com exceção de um grupo de elementos, é fruto da configuração eletrônica incompleta da maioria dos elementos químicos.
Ao se ligarem, os átomos tendem a adquirir 8 elétrons na camada de valência (última camada). Com isso, eles passam a ter a mesma estrutura eletrônica do gás nobre mais próximo.
É uma observação da natureza que os chamados gases nobres não costumam se ligar a outros elementos. Eles ‘preferem’ ficar ‘sozinhos’, ou seja, são encontrados não ligados, na forma de Ne, Xe, He. Tais elementos apresentam suas últimas camadas, as de valência, completas, com oito elétrons. Associou-se, portanto, a completude da última camada à estabilidade dos átomos.
Conectando-se os pontos, chegamos ao comportamento geral, com exceções, dos elementos na natureza. Eles tendem a se ligar para completar suas camadas de valência. Em geral, tendem a atingir oito elétrons na última camada. Eis a teoria do octeto.
Obs. É válido ressaltar que H e He têm apenas uma camada eletrônica em seus átomos. Dessa forma, o máximo de elétrons possíveis é 2. Logo, estes elementos se estabilizam com 2 elétrons na última camada.
Ligação iônica
Na ligação iônica, os elétrons são transferidos de um átomo com tendência a doar (metais) para um átomo com tendência a perder elétrons (ametais ou hidrogênio). Após a transferência, formam-se íons e estes se ligam por força eletrostática.
A diferença de eletronegatividade é, em geral, maior que 1,7 em ligações iônicas.
Exemplo:
Na e Cl
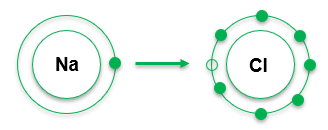
Para completar o octeto, o melhor para o sódio seria perder um elétron. O cloro, idealmente, ganharia um elétron para completar seu octeto.
Principais características
- Átomos dispostos em uma estrutura chamada retículo cristalino;
- Sólidos em temperatura ambiente;
- Apresentam elevada dureza;
- Apresentam baixa tenacidade;
- Possuem elevados pontos de fusão e ebulição;
- Conduzem corrente elétrica quando em solução;
- Conduzem energia elétrica nos estados líquido e gasoso.
Ligação Covalente
Esse tipo de ligação se dá por compartilhamento de um par de elétrons, sendo um elétron de cada átomo ou os dois elétrons do mesmo átomo. Há formação de moléculas, logo, esta ligação é também chamada de molecular. Ele acontece entre ametais ou entre o hidrogênio e um ametal, e entre hidrogênios. A diferença das eletronegatividades dos átomos envolvidos, geralmente, é menor que 1,7.
Exemplo:
O2
Eletronegatividade: O = 3,5
Δen: 3,5 - 3,5 = 0 → ligação covalente apolar
NH3
Eletronegatividades: N = 3,0 H = 2,1
Δen: 3,0 - 2,1 = 0,9 → ligação covalente polar
PSIU!!
Quando chamamos de ligação covalente dativa ou coordenada a ligação que ocorre entre um átomo que atinge a estabilidade eletrônica e outro que ainda necessita de dois elétrons para completar sua camada eletrônica, tendo assim os dois elétrons do compartilhamento vindo do mesmo átomo. Podemos representar esses pares de elétrons por uma seta.
Exemplo:
Usando o exemplo SO2, temos:
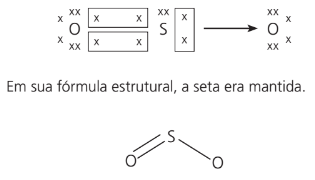
Principais características de compostos moleculares
- Pontos de fusão e ebulição baixos.
- À temperatura ambiente podem apresentar-se nos estados: sólido, líquido ou gasoso.
- Não são bons condutores de corrente elétrica em solução aquosa. Porém alguns ácidos fortes, por exemplo, em meio aquoso sofrem ionização (formação de íons), tornando a solução condutora de corrente elétrica.
- Pontos de fusão e de ebulição menores que os dos compostos iônicos (as forças entre moléculas são menores porque não há a atração elétrica provocada pelos íons).
- Pouca solubilidade em água.
- Tendem a ser mais inflamáveis que os compostos iônicos (carbono e hidrogênio queimam facilmente e são encontrados em grande parte dos compostos covalentes).
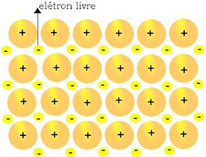
Ligação Metálica
Em materiais com este tipo de ligação, os elétrons se movem livremente (“mar de elétrons”) pelos átomos de metal da estrutura. Este é o motivo da alta condutividade dos metais e da sua aplicabilidade em circuitos elétricos.
Ligas metálicas são formadas por dois ou mais metais ou um metal com um ametal em quantidade pequena.
Veja algumas ligas metálicas comuns:
Aço: Fe e C
Aço inox: Fe + C + Ni + Cr
Bronze: Cu + Sn
Latão: Cu + Zn
Ouro: Au + Ag ou Au + Cu
Principais características
- A maioria é sólida na temperatura ambiente, com exceção do mercúrio (Hg);
- Possuem altas temperaturas de fusão e ebulição;
- Conduzem eletricidade (elétrons livres);
- São insolúveis em água;
- Possuem brilho, são maleáveis e dúcteis.
III. Ligações intermoleculares
1 - Dipolo induzido-dipolo induzido, van der Waals ou dipolo-induzido → Ocorre nas moléculas apolares.
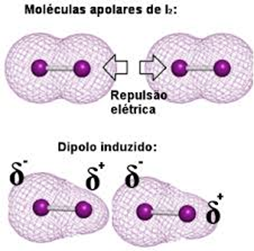
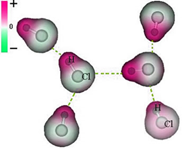
2 - Dipolo permanente-dipolo permanente ou dipolo-dipolo → Ocorre nas moléculas polares.
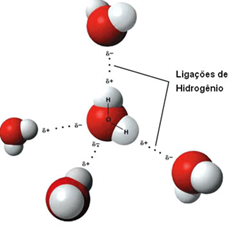
3 - Ligação de Hidrogênio: Antes essa força era chamada de ponte de hidrogênio. As ligações de hidrogênio são atrações intermoleculares fortíssimas que ocorrem entre moléculas polares que apresentam ligações do Hidrogênio com átomos muito eletronegativos como o Flúor, Oxigênio e Nitrogênio.
Atenção!
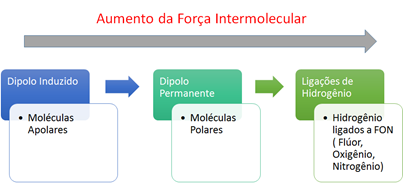
O aumento da força é proporcional aos pontos de fusão e ebulição dos compostos.
Atenção!
Ligação Íon-dipolo
A interação íon-dipolo envolve um íon e uma molécula polar, de forma que as cargas que possuam caráter atrativo se aproximam. Portanto, quanto maior a carga do íon relativamente ao dipolo, maior a intensidade da ligação (melhor será a atração).