Processos endo e exotérmicos
Entalpia
Relação entre variação de entalpia e quantidades de reagentes e produtos
A Entalpia de formação
Cálculo da variação de entalpia a partir das entalpias de formação
A maior parte das transformações físicas e químicas envolvem perda ou ganho de calor, e ele é sem dúvida a forma mais comum de energia que acompanha as reações químicas. E isso acaba resultando a importância do estudo do calor das reações na físico-química, denominamos termoquímica.
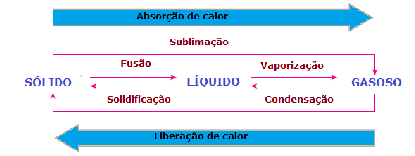
Termoquímica é o estudo das quantidades de calor liberadas ou absorvidas durante as reações químicas.
Para a Termoquímica, as reações químicas se classificam em:
1: Reações exotérmicas (∆H < 0): São as que produzem ou liberam calor, como por exemplo:
A queima do carvão: C + O2 → CO2 + Calor
A combustão da gasolina: C8H18 + 25/2 O2 →8 CO2 + 9H2O + Calor
Observe que, nesses exemplos, estamos considerando o calor como se fosse um dos “produtos” da reação
2: Reações endotérmicas (∆H > 0): São as que absorvem calor, como por exemplo:
A decomposição do carbonato de cálcio: CaCO3 + Calor → CaO + CO2
A síntese do óxido nítrico: N2 + O2 +Calor → 2NO
Já nesses caso, veja que estamos considerando o calor como um “reagente” necessário ao andamento da reação.
Existem alguns conceitos básicos, porém importantes, da termoquímica e da calorimetria, como por exemplo:
- 1 cal é quantidade de energia necessária pra aquecer 1,0 grama de água pura em 1ºC (1 cal = 4,8 kJ)
- Entalpia (H) é uma grandeza física que mede a energia térmica de um sistema e sua unidade pelo sistema internacional é dado em Joule (J). O rompimento e reagrupamento das ligações nas moléculas que geram esse calor, não há forma de se determinar a entalpia, porém conseguimos determinar com precisão a variação de entalpia (H) que é a medida da quantidade de calor liberada ou absorvida pela reação, a pressão constante.
Gráficos termoquímicos
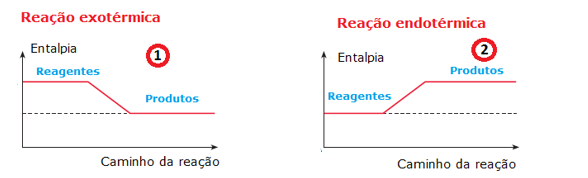
Vemos que o gráfico 1 representa uma reação exotérmica, ou seja, identificamos que a energia dos produtos é menor que a energia dos reagentes, logo houve uma liberação de calor. Em contrapartida, no gráfico 2 percebemos que a energia do produtos é maior do que a energia dos reagentes, logo, houve uma absorção de calor por parte dos reagentes.
Cálculo da variação de entalpia
Na termoquímica, como havíamos dito, não é possível medir a entalpia das substâncias. O que se pode medir e calcular com precisão é a variação de entalpia ao longo das transformações químicas destas substâncias.
Definimos então a variação de entalpia(∆H) algebricamente como:
∆H = Hprodutos - Hreagentes
Considere o seguinte exemplo, com todas as substâncias no estado padrão:
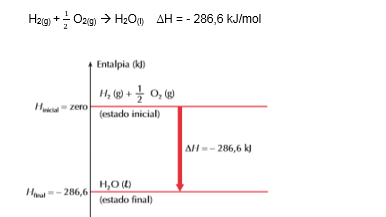
Podemos interpretar o gráfico da seguinte maneira: o H2(g) e o 1/2 O2(g) estão no nível zero, logo tem valor de entalpia igual a zero, pois são substâncias simples e estão no estado padrão.
Analisando o ∆H < 0 , concluímos que a reação é exotérmica e que o sistema em reação perde energia (calor) para o meio ambiente. Consequentemente, o produto final (H2O(l)) ficará em um nível de energia mais baixo (- 286,6 kJ).
Podemos então provar o ∆H dado como:

Esse valor é chamado de entalpia (ou calor) padrão de formação do H2O(l) e é designado por ∆ H°f , em que o expoente zero indica o estado padrão, e o índice f indica que se trata da entalpia de formação.
Definimos então:
Entalpia (ou calor) padrão de formação de uma substância é a variação de entalpia verificada na formação de 1 mol da substância, a partir das substâncias simples correspondentes, estando todas no estado padrão.
