Volume parcial e fração molar
Volumes parciais e volume total da mistura
Questão sobre Pressão Parcia
Questão sobre Volume Parcial
A massa molar aparente
Fração molar
Fração molar é calculada pelo número de mols de uma substância sobre o número de mols totais.
Xi = ni/nt
Importante!
Número de mols totais (n_tt) é igual a soma do número de mols de todos todos os participantes da mistura.
n_tt = n_11 + n_22 + n_33 + …
Exemplo:
Uma solução formada por 1 mol de glicose e 99 mol de água. Qual a fração molar de água e glicose?
Aplicando a fórmula:
nt = n agua + n glicose
nt = 1 + 99 = 100 mol
Jogando na fórmula de fração molar:
Para a água: n agua = n agua/n totais = 1/100 = 0,01
Para a glicose: n glicose = n glicose/n totais = 99/100 = 0,99
Perceba que o somatório de 0,01 + 0,99 é igual 1. E isso sempre será verdade, a soma das frações molares, sempre será igual a 1. Sendo assim, se nós tivermos uma fração molar, nós podemos subtrair de 1 para achar a segunda.
OBS: Fração molar é adimensional, ou seja, não possui unidade.
Pressão parcial
Além de chegarmos na fração molar a partir do número de mols, nós podemos fazer a relação com as pressões parciais. A ideia é a mesma, porém nós iremos substituir número de mol por pressão parcial.
Xa = Pa/Pt
Pressão total é igual a soma das pressões parciais da mistura.
Volume parcial
O volume parcial de um gás será o volume que um gás da mistura ocupariá se estivesse sozinhos nas mesma condições de pressão e temperatura da mistura.
Veja um exemplo para ficar mais claro
Considere dois balões contendo quantidades quaisquer de dois gases diferentes na mesma temperatura.

Cada balão irá possuir uma certa quantidade de gás. Nós podemos afirmar que quanto maior for essa quantidade, maior o volume do balão. Pense numa bexiga, quanto mais ar nós colocarmos lá dentro, maior será a bexiga, maior será o seu volume.
Imagine agora que nós iremos juntar esse dois balões em um único balão. De maneira que nenhum gás seja perdido. Vamos imaginar que nós conseguimos transferis todo o conteúdo do balão A e do balão B para um novo balão.
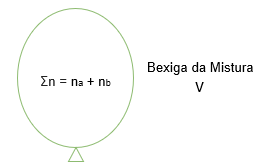
Podemos concordar que esse novo volume (da mistura gasosa) é maior do que o volume de Va e Vb, porque agora nós temos uma quantidade maior de gás.
Pensando na definição de volume parcial, se nós conseguirmos separar os gases dessa mistura, nós chegaríamos no volume parcial de cada gás.
Aplicando a equação, PV = nRT, para cada balão nós podemos chegar na seguinte relação:
OBS: Pressão e temperatura são as mesmas para todos os balões, logo chamaremos só de P e T. Vamos chamar o volume da mistura apenas de V.
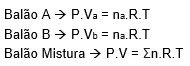
Relacionando o balão A com o balão da mistura:
Como nós temos P, R e T iguais em ambos os balões, nós podemos dividir uma equação pela outra para simplificar:
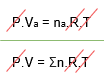
Chegando então na relação:
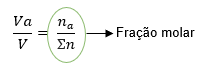
Portanto nós temos que a fração molar está diretamente relacionada com o volume parcial de um gás e o volume total.
Xa = na/n totais
OBS: Podemos fazer a mesma coisa para o gás b. Chegabdo na mesma equação, mas em função do balão b.
Importante!!!
O volume total da mistura gasosa, pode ser calculada a partir do volume parcial de cada gás que forma a mistura.
No caso do exemplo da bexiga A e B. O volume da mistura será calculado por:
V = Va + Vb
Exemplo1:
Um determinado fraco de volume 100 mL contém 12g de gás hidrogênio (H2) e 32g de gás metano (CH4), nas pressão de 2 atm.
Dado: H2 = 2 g/mol/ CH4 = 16 g/mol
Determine:
a) frações molares;
b) pressões parciais;
c) volumes parciais.


Exemplo2:
Considere dentro que um balão, uma amostra de 100 mol de ar atmosférico. Qual será a massa de 1 mol de ar?
Dados: Ar atmosférico formado por: 78% em volume de N2, 21% em volume de O2 e 1% de Ar.
N2 = 28 g/mol; O2 = 32 g/mol; Ar = 40 g/mol
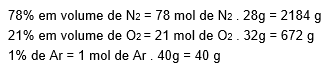
Somando essas massa nós chegamos em 2896 g, que é a massa de 100 mol de ar atmosférico. Agora fazendo uma regra de três para saber quanto de massa nós temos para um mol de ar atmosférico.

Essa é uma média da massa molar do ar atmosférico, também conhecida como massa molar aparente.
Massa molar aparente
Fórmula geral para qualquer mistura gasosa:
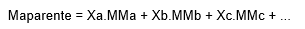
Nos caso do ar atmosférico nós teríamos:
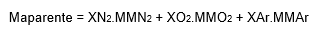
Substituindo todos os valores nós chegaríamos também em 28,96 g/mol.