Exercício 1
Exercício 2
Exercício 3
Exercício 4
Exercício 5
Exercício 6
Afim de explicar a acidez e basicidade dos compostos químicos algumas teorias foram propostas ao longo da história da química. Essas três teoria ficaram conhecidas, em ordem cronológica, como:
Teoria de Arrhenius
Ácido: são compostos que, em água, sofrem ionização e liberam como único cátion o H^{+}+.
HA ⇌ H+ + A−
Ex.: HCl ⇌ H+ + Cl−
Bases: são compostos que, em água, sofrem dissociação iônica e liberam como único ânion o OH-.
XOH ⇌ X+ + OH−
Ex.: NaOH ⇌ Na+ + OH−
Força ácido-base
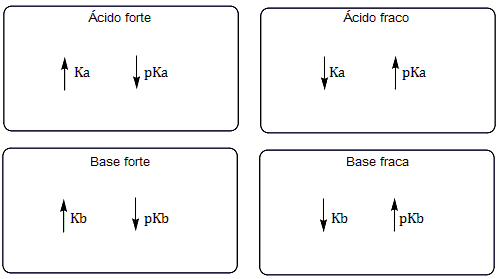
Obs.: A utilização do Ka, pKa, Kb e pKb será aprofundada quando chegarmos no estudo dos equilíbrios iônicos.
Teoria de Bronsted-Lowry
Ácido: são compostos capazes de ceder H+.
Bases: são compostos capazes de receber H+.
HCl + H2O ⇌ H3O+ + Cl−

Obs.:
Ácido forte produz Base conjugada fraca
Ácido fraco produz Base conjugada forte
Base forte produz Ácido conjugado fraco
Base fraca produz Ácidoconjugado forte
Teoria de Lewis
Ácido: são compostos capazes de receber par de elétrons.
Bases: são compostos capazes de ceder par de elétrons.
NH3 + H2O ⇌ NH4^+ + OH−
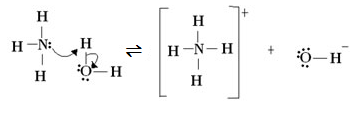
NH3 possui N que possui par de elétrons livre para ceder.
H2O possui H que é capaz de receber o par de elétrons livre do N.