Pressão de vapor
Ponto de congelamento
Pressão de Vapor - Gráfico
Osmose
Comportamento da uma célula
Solução e temperatura de ebulição
Coloide
Classificação de colóides
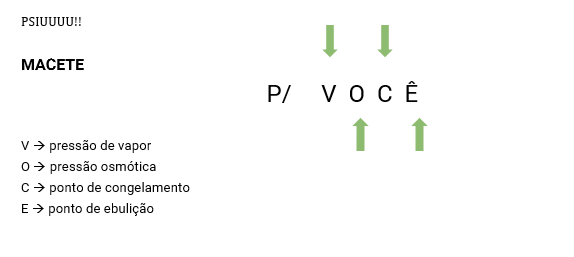
Propriedades coligativas
Quando adicionamos soluto não volátil a um solvente, o sistema resultante passa a ter um conjunto específico de propriedades diferentes das do composto puro inicial, as quais chamamos de propriedades coligativas.
Mas o que são solutos não voláteis (SNV)?
Volatilidade
É uma propriedade física de líquidos que pode ser definida como a capacidade de ele virar vapor. É perceptível para nós que a acetona e o álcool etílico viram vapor com facilidade muito maior que a da água, por isso dizemos que são mais voláteis.
Sendo assim, SNVs são aqueles que não viram vapor ou gás com facilidade, à temperatura ambiente. Os sais e as bases cujos cátions são metais (hidróxidos metálicos), por exemplo, são solutos não voláteis.
É muito importante saber que, quanto maior for o número de espécies dissolvidas no sistema, mais intensa será a forma como essas propriedades irão ocorrer.
Obs: espécie é um termo genérico para designar todo e qualquer tipo de substância ou partícula presente na natureza, bem como nas diversas reações que nela ocorrem. Por exemplo, um recipiente com NaCl dissolvido em água não possui uma só espécie dissolvida, embora possua apenas um composto químico dissolvido. Na verdade, este sistema possui duas espécies dissolvidas: um Na+ e um Cl-.
Veja:
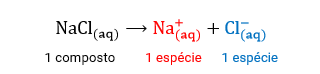
Antes de estudarmos cada propriedade coligativa, é importante sabermos distinguir dois tipos de solução:
Solução iônica: obtemos ao dissolvermos um composto iônico no solvente. Assim, as partículas presentes serão íons. Exemplos: NaCl, Ca(OH)2, NH4Cl, etc.
Solução molecular: obtemos ao dissolvermos um composto molecular/covalente no solvente. Assim, as partículas presentes serão moléculas. Exemplos: C6H12O6, C2H22O11, etc.
A diferença de comportamento de cada um desses tipos de soluto influi nos efeitos coligativos, uma vez que compostos iônicos se dissociam no solvente, gerando mais espécies dissolvidas do que os compostos moleculares, que não se dissociam.
Tomemos como exemplos o NaCl e a C12H22O11:
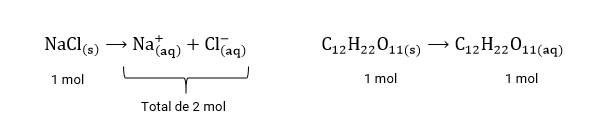
Dessa forma, no caso ilustrado, as propriedades coligativas na solução de cloreto de sódio serão mais intensas do que na solução de sacarose.
Obs: Os ácidos, embora sejam compostos moleculares e não sofram dissociação iônica, eles sofrem ionização em meio aquoso. Ou seja, o composto não é iônico, mas em água ele gera íons.
A propriedades coligativas:
Tonoscopia (Pv)
É a propriedade coligativa que estuda a DIMINUIÇÃO da pressão máxima de vapor de um solvente, quando se adiciona soluto não volátil (SNV).
A pressão de vapor é aquela que o vapor de um solvente exerce sobre o meio onde está inserido. Se temos uma panela tampada com água, mesmo à temperatura ambiente (digamos 30°C), parte da água líquida vaporiza, por ser volátil. Esse vapor d’água, ao atingir um nível de saturação para aquele meio, condensa-se, formando água líquida novamente, que vaporiza, e depois condensa, sucessivamente, gerando um sistema em equilíbrio. Dessa forma, chega-se a um ponto em que a quantidade de água condensada e vaporizada permanecem constantes. Nesse ponto, a agitação das moléculas de água vaporizadas no recipiente exerce a chamada pressão máxima de vapor ali dentro (pelo número de moléculas em forma de vapor ser o maior possível, já que o sistema já se encontra equilibrado).
Quando adicionamos SNV a esse sistema, no entanto, as partículas do tal soluto, dissolvidas, interagem entre si e com as moléculas do solvente (água) com uma força de atração (explicada pela polaridade das substâncias) que dificulta o desprendimento de moléculas deste último da fase líquida para a fase de vapor. Com isso, o número de moléculas de água vaporizadas no recipiente é menor, e, portanto, exerce menor pressão naquele meio, mesmo quando alcança uma situação de equilíbrio entre as fases.
Neste caso, então, dizemos que a pressão máxima de vapor (Pv) da água pura é maior que a de uma solução de NaCl. Mas e uma solução de sacarose (C12H22O11) em relação à de NaCl (quantidades iguais dos solutos)? Bem, neste caso, como a solução de NaCl possui maior número de espécies dissolvidas, a Pv será menor que a da solução de C12H22O11.
Importante!
Cada líquido possui um valor próprio de pressão de vapor, que pode variar somente com a alteração da temperatura.
Quanto mais volátil for um líquido, maior será sua pressão máxima de vapor. Se os líquidos A e B estão dentro de recipientes separados sob a mesma temperatura, e o B é mais volátil que o A, então ele libera mais moléculas de vapor para o recipiente do que o A. Sendo assim, a pressão exercida por suas moléculas vaporizadas será maior que a exercida pelas moléculas vaporizadas do A.
Osmometria (Po)
Estuda o AUMENTO da pressão osmótica das soluções, ao adicionarmos SNV.
• Tipos de solução quanto à concentração de soluto:
Quanto mais soluto há em uma solução, mais concentrada ela é. Quanto menos soluto, mais diluída é a solução. Ao compararmos duas soluções, surgem algumas classificações importantes para entendermos a osmometria. São elas:
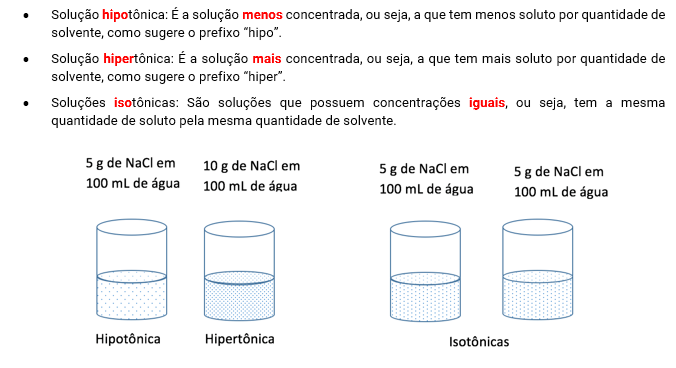
Se temos um recipiente dividido por uma membrana semipermeável (através da qual o solvente pode atravessar, mas o soluto não), e os dois lados da solução possuem concentrações diferentes, o solvente tende a se difundir para o lado HIPERTÔNICO, a fim de igualar as concentrações dos dois lados. A esse processo damos o nome de osmose.
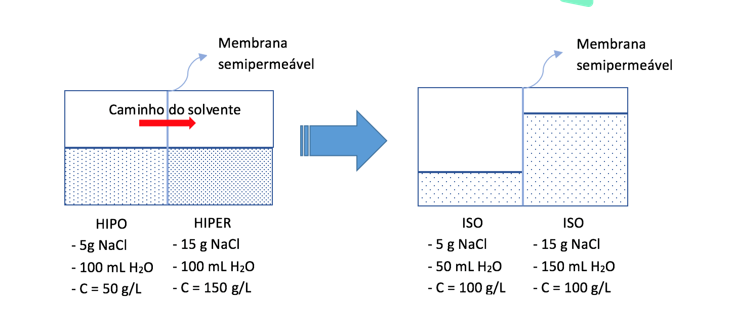
A pressão osmótica é aquela que exercemos artificialmente para impedir a passagem natural de solvente do meio hipotônico para o meio hipertônico. Se o acréscimo de soluto a um dos lados da membrana semipermeável aumenta a tendência de o solvente se difundir para o meio hipotônico, então a pressão osmótica que precisamos aplicar para impedir essa passagem também aumenta. Ou seja, quanto mais SNV, maior é a Po da solução.
É bom saber:
A osmose reversa é um método usado para transformar água salobra em água potável; para dessalinizar água de mar. Consiste na aplicação de pressão superior à pressão osmótica da água do mar, para impulsionar o solvente (água pura) a passar para a solução mais diluída, sem levar junto os sais que havia no conteúdo. Por ser contra o caminho natural da osmose, esse processo é caro e, portanto, difícil de ser utilizado por países mais pobres, que geralmente são os que mais sofrem com a falta de água potável.
Ebulioscopia (Pe)
Estuda o AUMENTO do ponto de ebulição de um sistema aquoso ao acrescentarmos SNV.
O ponto de ebulição é a temperatura em que a pressão de vapor de um líquido se iguala à pressão do ambiente em que está, fazendo com que a vaporização do mesmo ocorra de forma mais rápida e turbulenta. Sendo assim, a temperatura de ebulição de uma substância varia sob diferentes valores de pressão atmosférica: quanto menor for a pressão externa ao líquido, menor será sua temperatura de ebulição . A água, por exemplo, ferve a menos de 100°C em altitudes mais elevadas.
Como vimos na tonoscopia, ao adicionarmos SNV a certa quantidade de água, suas partículas dissolvidas interagem quimicamente com as moléculas de água, atrapalhando a vaporização dela. Com isso, além de a Pv diminuir, o ponto de ebulição desse solvente aumenta. E quanto maior for a quantidade de soluto adicionado e dissolvido, maior ficará o ponto de ebulição da solução.
Exemplo: Quando adicionamos 1 mol de NaCl em 1L de água, a solução final contém 2 mol de espécies dissolvidas, segundo a proporção analisada na reação de dissolução acima. Mas se acrescentarmos a mesma quantidade (1 mol) de MgCl_22 a 1L de água, a solução final conterá 3 mol de espécies dissolvidas.
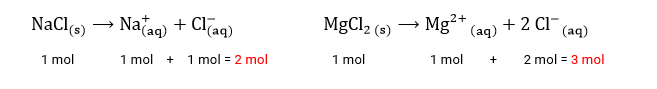
Importante!: Cada composto químico possui seu próprio valor de temperatura de ebulição.
É bom saber:
Quando cozinhamos algo na panela de pressão, o tempo de cozimento é menor do que quando usamos a panela normal, e quem explica isso é a ebulioscopia. Como a pressão dentro da panela é superior à pressão atmosférica normal, o ponto de ebulição da água aumenta e, assim, a água líquida que está em contato com o alimento alcança temperaturas mais elevadas, acelerando a velocidade de cozimento (OBS: como aprendemos em cinética química, a temperatura é um dos fatores que intervêm na velocidade das reações).
Crioscopia (Pc)
Estuda a DIMINUIÇÃO do ponto de congelamento das soluções, ao adicionarmos SNV.
O ponto de congelamento é a temperatura em que um líquido passa para a fase sólida, ou seja, o ponto em que as moléculas do líquido interagem entre si de maneira mais intensa, aproximando-se e assumindo uma forma menos “espalhada” que a líquida, uma forma cristalizada.
Quando adicionamos SNV à água, por exemplo, seu ponto de congelamento se torna inferior a 0°C (o normal à pressão de 1 atm). Isso ocorre porque as partículas dissolvidas de soluto se interpõem entre as moléculas do solvente, dificultando a interação – aproximação – entre elas. Assim, faz-se necessária uma temperatura mais baixa para que a água se cristalize.
É bom saber:
Algumas pessoas, para resfriarem mais rapidamente garrafas de bebida mantidas em recipientes com gelo, jogam sal de cozinha no recipiente. Dessa forma, a temperatura de congelamento daquele gelo abaixa, levando ao seu derretimento. Com isso, expõem as áreas mais internas (mais frias) do gelo ao contato com as garrafas, resfriando-as.
Resumindo:
Ao adicionarmos solutos não voláteis a um solvente,
• Sua pressão de vapor diminui;
• Sua pressão osmótica aumenta;
• Seu ponto de ebulição aumenta;
• Seu ponto de congelamento diminui.
Coloide
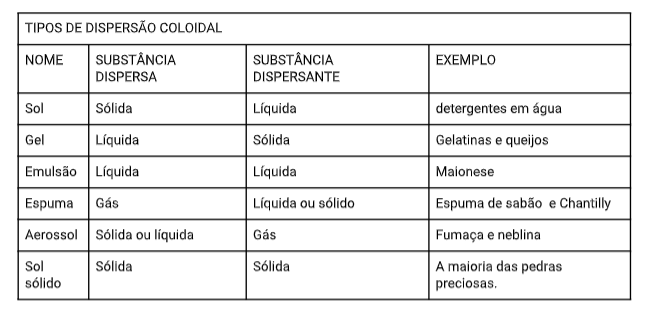
Mistura heterogênea, formada por partículas dispersas com tamanho entre 1 e 1000 nm. Os coloides não sedimentam e nem podem ser filtrados por filtração comum. Muito cuidado! Pois, muitas vezes os coloides são confundidos com misturas homogêneas quando
observadas a olho nu. Veja os tipos e alguns exemplos de coloides na próxima página:
Efeito Tyndall
Este efeito ocorre quando há dispersão da luz por partículas coloidais. Neste fenômeno é possível visualizar o trajeto que a luz percorre através das partículas dispersas. A dispersão da luz deve-se ao fato do tamanho das partículas ser da mesma ordem de grandeza do comprimento de onda da radiação visível.

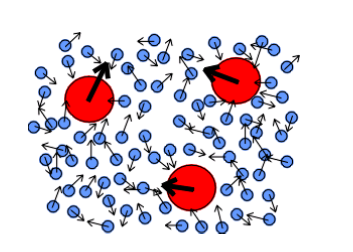
Movimento browniano
É o movimento aleatório de partículas em uma dispersão, como consequência dos choques entre todas as partículas presentes no fluido, pode ser usado para se referir a uma grande diversidade de movimentos presentes em estados desde micro até macroscópicos.