Exercício 1 – identificação de óxidos
Exercício 2 – Nomenclatura e reação de neutralização
Exercício 3 - Neutralização Total e Neutralização Parcial do H3PO4
Exercício 4 – identificação de soluções eletrolíticas
Exercício 5 – condutividade elétrica das bases
Exercício 6 – identificação dos sais
Exercício 7 – reação de neutralização, fórmula estrutural e configuração eletrônica
Número de oxidação (nox)
O NOX é a carga que um elemento adquire depois de realizar qualquer tipo de ligação para atingir a estabilidade (regra do octeto) ou de se manter no seu estado fundamental.
Em compostos iônicos, número de oxidação (Nox) é a própria carga elétrica do íon, ou seja, o número de elétrons que o átomo perdeu ou ganhou.
No caso dos compostos covalentes, por não ter perda ou ganho de elétrons, pode estender o conceito de número de oxidação, dizendo que seria a carga elétrica teórica que o átomo iria adquirir se houvesse quebra da ligação covalente, ficando os elétrons com o átomo mais eletronegativo.
Para calcularmos o nox dos elementos de uma substância devemos igualar a soma das cargas à 0. Caso seja um íon devemos igualar a soma dos nox a carga do íon. E em substâncias simples o nox é sempre igual a 0
Exemplos (Na2CO3 e K2Cr2O7):
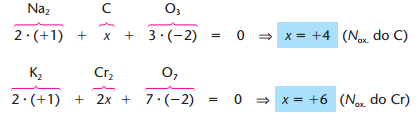
Ou exemplo no caso dos íons (MnO4^{−1} e NH4 +):
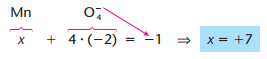
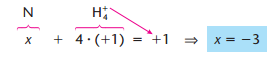
Como nos sabíamos que o nox do Na era +1? Isso foi possível devido a algumas regras. Temos alguns elementos que apresentam nox fixo. Na tabela a baixo, temos uma lista com esses elementos.
Elementos com número de oxidação fixo
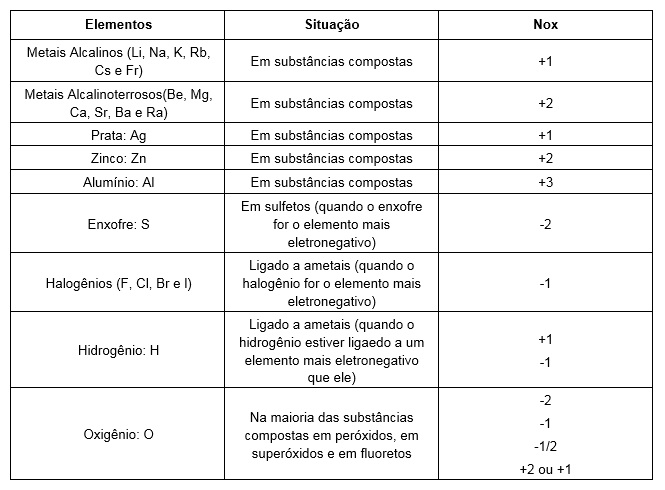
Nox variável
Alguns elementos de transição (família B) tem nox variável, ou seja, depende com quem ele está ligado, a seguir temos uma lista dos mais comuns:
Número de oxidação compostos orgânicos
Nesse caso, nós iremos olhar para da ligação. O elemento que for mais eletronegativo recebera a carga -1 o e menos eletronegativo, a carga +1. Caso os elementos sejam iguais, a carga será zero. No caso das ligações duplas e triplas, devemos colocar -1 ou +1, para cada ligação.
Etanol
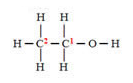
Ácido acético
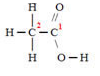
Vamos considerar cada carbono separadamente. Primeiro o carbono 1:
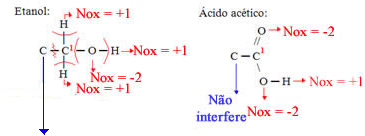
Não há diferença de eletronegatividade, porque é uma ligação entre dois carbonos, portanto, nenhum deles ganha ou perde elétrons nessa ligação e não há interferência no Nox do carbono 1.
Considerando as perdas e ganhos de elétrons do carbono 1, temos:
Etanol:
Ganhos: 3eletrons de cada hidrogênio;
Perdas: 2 elétrons para cada oxigênio;
Total: Ficou com 1 elétrons a mais, assim, seu Nox = - 1
Ácido acético:
Ganhos: 1 elétrons de cada hidrogênio;
Perdas: 4 elétrons para cada oxigênio;
Total: Ficou com 3 elétrons a menos, assim, seu Nox = +3
Agora vamos considerar o Nox do carbono 2,que é o mesmo tanto no etanol quanto no ácido acético:
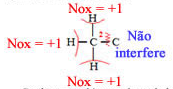
Ganhos: 3 elétrons de cada hidrogênio;
Perdas: Nenhuma;
ÓXIDOS
Óxidos são compostos binários (2 elementos) nos quais o oxigênio é o elemento mais eletronegativo.
Por exemplo: H2O, CO2 , Fe2O3 , SO2 , P2O5 etc.
Existem compostos binários com oxigênio onde ele não é o mais eletronegativo, então não pode ser considerado um óxido, são eles:
OF2 e O2F2 que são considerados sais, pois nesse caso o flúor é o elemento mais eletronegativo, saindo assim da definição de óxidos.
BASES
Segundo Arrhenius, são substâncias inorgânicas que quando colocadas em presença de água sofrem dissociação iônica, liberando como único ânion a hidroxila (OH-).
XOH → X+ + OH−
ÁCIDOS
Segundo Arrhenius, são substâncias inorgânicas que quando colocadas em presença de água sofrem ionização, liberando como único cátion o H+.
HA → H+ + A−
HAO → H+ + AO−
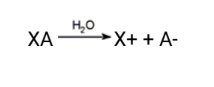
SAIS
Sal é toda substância, que em solução aquosa, libera pelo menos um cátion diferente de H+ e um ânion diferente de OH-