Exercício 1 – Números de oxidação do Crômio
Exercício 2 – Cálculo de nox de elementos selecionados
Exercício 3 – Óxidos ácidos e chuva ácida
Exercício 4 – Óxidos e suas reações com água.
Exercício 5 – Óxidos básicos e suas reações com água
Exercício 6 – Comportamento de óxidos anfóteros
Número de oxidação (nox)
O NOX é a carga que um elemento adquire depois de realizar qualquer tipo de ligação para atingir a estabilidade (regra do octeto) ou de se manter no seu estado fundamental.
Em compostos iônicos, número de oxidação (Nox) é a própria carga elétrica do íon, ou seja, o número de elétrons que o átomo perdeu ou ganhou.
No caso dos compostos covalentes, por não ter perda ou ganho de elétrons, pode estender o conceito de número de oxidação, dizendo que seria a carga elétrica teórica que o átomo iria adquirir se houvesse quebra da ligação covalente, ficando os elétrons com o átomo mais eletronegativo.
Para calcularmos o nox dos elementos de uma substância devemos igualar a soma das cargas à 0. Caso seja um íon devemos igualar a soma dos nox a carga do íon. E em substâncias simples o nox é sempre igual a 0
Exemplos (Na2CO3 e K2Cr2O7):
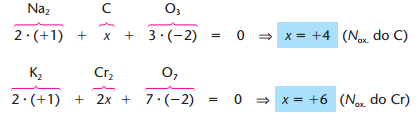
Ou exemplo no caso dos íons (MnO4^{−1} e NH4 +):
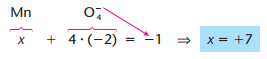
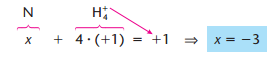
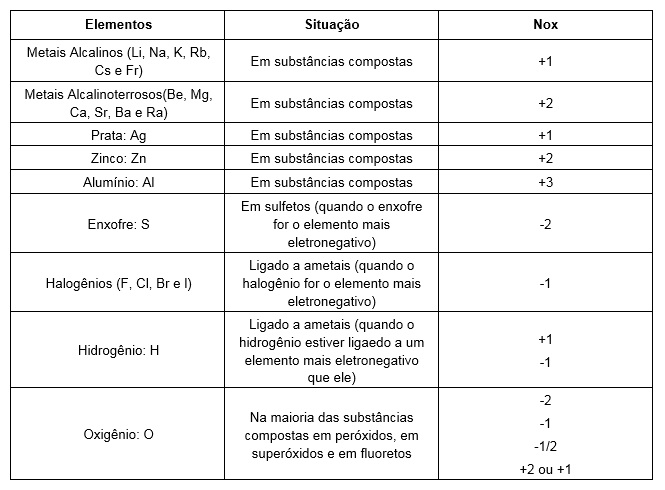
Como nos sabíamos que o nox do Na era +1? Isso foi possível devido a algumas regras. Temos alguns elementos que apresentam nox fixo. Na tabela a baixo, temos uma lista com esses elementos.
Elementos com número de oxidação fixo
Nox variável
Alguns elementos de transição (família B) tem nox variável, ou seja, depende com quem ele está ligado, a seguir temos uma lista dos mais comuns:
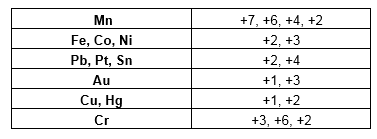
Número de oxidação compostos orgânicos
Nesse caso, nós iremos olhar para da ligação. O elemento que for mais eletronegativo recebera a carga -1 o e menos eletronegativo, a carga +1. Caso os elementos sejam iguais, a carga será zero. No caso das ligações duplas e triplas, devemos colocar -1 ou +1, para cada ligação.
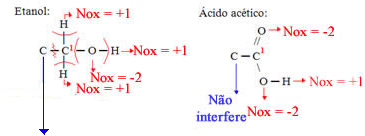
Etanol
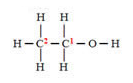
Ácido acético
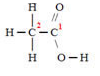
Vamos considerar cada carbono separadamente. Primeiro o carbono 1:
Não há diferença de eletronegatividade, porque é uma ligação entre dois carbonos, portanto, nenhum deles ganha ou perde elétrons nessa ligação e não há interferência no Nox do carbono 1.
Considerando as perdas e ganhos de elétrons do carbono 1, temos:
Etanol:
Ganhos: 3eletrons de cada hidrogênio;
Perdas: 2 elétrons para cada oxigênio;
Total: Ficou com 1 elétrons a mais, assim, seu Nox = - 1
Ácido acético:
Ganhos: 1 elétrons de cada hidrogênio;
Perdas: 4 elétrons para cada oxigênio;
Total: Ficou com 3 elétrons a menos, assim, seu Nox = +3
Agora vamos considerar o Nox do carbono 2,que é o mesmo tanto no etanol quanto no ácido acético:
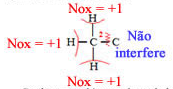
Ganhos: 3 elétrons de cada hidrogênio;
Perdas: Nenhuma;
ÓXIDOS
Óxidos são compostos binários (2 elementos) nos quais o oxigênio é o elemento mais eletronegativo.
Por exemplo: H2O, CO2 , Fe2O3 , SO2 , P2O5 etc.
Existem compostos binários com oxigênio onde ele não é o mais eletronegativo, então não pode ser considerado um óxido, são eles:
OF2 e O2F2 que são considerados sais, pois nesse caso o flúor é o elemento mais eletronegativo, saindo assim da definição de óxidos.
Classificação dos óxidos
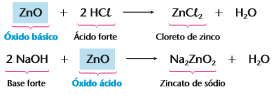
Óxidos básicos: São óxidos que reagem com a água, produzindo uma base, ou reagem com um ácido, produzindo sal e água, geralmente óxidos onde o metal tem nox +1,+2 ou +3.
Exemplo:
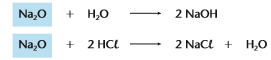
Nomenclatura dos óxidos básicos
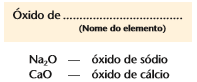
Quando o elemento forma apenas um óxido, nomeamos com a palavra óxido + o nome do elemento, exemplo:
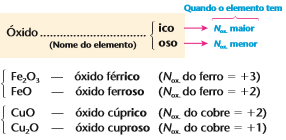
Caso o elemento forme mais de um óxido (nox variável), acrescentamos o sufixo ico(maior nox) ou oso (menor nox) ao nome do metal em questão, exemplo:
Podemos representar também com nome escrito com algarismos romanos:
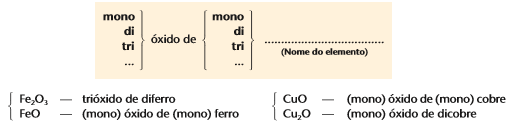
Outra forma de nomear os óxidos é usando algarismos romanos, exemplo:
Fe2O3: Óxido de ferro III
FeO: Óxido de ferro II
CuO: Óxido de cobre II
Cu2O: Óxido de cobre I
Óxidos ácidos ou anidridos: São óxidos que reagem com a água, produzindo um ácido, ou reagem com uma base, produzindo sal e água, onde o nox do metal (nox possíveis: +5, +6 ou + 7) ou com qualquer ametal (excluindo os ametais dos óxidos neutros).
Exemplo:
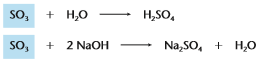
O nome anidrido vem do fato desse tipo de óxido ter a capacidade absorver água e forma seu respectivo ácido.
Exemplo: SO3 + H2O → H2SO4
Anidrido sulfúrico, óxido de enxofre IV ou trióxido de enxofre + água → Ácido sulfúrico
Nomenclatura dos óxidos ácidos
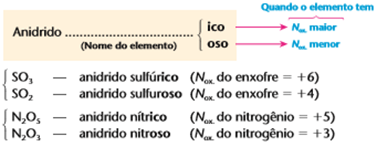
Obs1 : Quando o elemento possuir 4 anidridos diferentes, ou seja, 4 nox diferentes
Nox+1: Anidrido Hipo…oso
Nox +3: Anidrido…oso
Nox +5: Anidrido…ico
Nox +7: Anidrido Per…ico
Exemplos:
Cl2O: Anidrido Hipocloroso
Cl2O3: Anidrido cloroso
Cl2O5: Anidrido clórico
Cl2O7: Anidrido Perclórico
Obs2: Quando o óxido tem apenas um um anidrido, usa-se a terminação ico.
Exemplo:
CO2 — anidrido carbônico
B2O3 — anidrido bórico
Obs3: Podemos usar a terminação já citada utilizando números romanos ou os prefixos mono,di,tri…
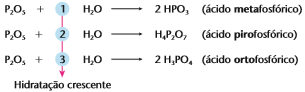
Obs4: Alguns anidridos podem reagir com quantidades crescentes de água (hidratação crescente), produzindo ácidos diferentes. É o caso do anidrido fosfórico (P2O5 ).
Óxidos anfóteros: Podem se comportar ora como óxido básico, ora como óxido ácido, onde o metal pode ter nox +3 ou +4(exceção do Zn,Pb,Sn) ou o oxigênio estar ligado a um ametal(excluindo os ametais dos óxidos neutros).
Os óxidos anfóteros são, em geral, sólidos, iônicos, insolúveis na água. Os mais vistos em provas ou vestibulares são:
ZnO; Al2O3; SnO ; SnO2 ; PbO ; PbO2; As2O3; As2O5; Sb2O3 e Sb2O5.
Nomenclatura dos óxidos anfóteros
A nomenclatura é idêntica à dos óxidos básicos:
ZnO — óxido de zinco
SnO2 — óxido estânico ou óxido de estanho IV, ou dióxido de estanho
SnO — óxido estanoso ou óxido de estanho II, ou (mono) óxido de estanho
Óxidos neutros: São óxidos que não reagem com água, nem com ácidos nem com bases. Existem muito poucos óxidos com essa classificação, os exemplos mais comuns são:
CO - monóxido de carbono
N2O-óxido nitroso
NO - óxido nítrico
Obs: Muitos autores consideram a água(H2O) um óxido neutro.
Óxidos duplos, mistos ou salinos: São óxidos que se comportam como se fossem formados por dois outros óxidos, do mesmo elemento químico, onde seu nox equivale a 8/3.
Exemplo:
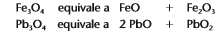
Para dar nome aos óxidos duplos, mistos ou salinos, devemos seguir esta regra:
Tetraóxido + de + nome do elemento + tri = nome do elemento ligado ao Oxigênio
Exemplos:
Fe3O4 = Tetraóxido de triferro
Pb3O4 = Tetraóxido de trichumbo
Mn3O4 = Tetraóxido de trimanganês
Peróxidos: São óxidos que reagem com a água ou com ácidos diluídos, produzindo água oxigenada (H2O2).
Exemplo:
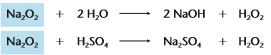
A nomenclatura é feita com a própria palavra peróxido. Por exemplo:
Na2O2 - Peróxido de sódio
E os peróxidos mais comuns são os de hidrogênio, e utilizando metais da família 1A e 2A.
Superóxidos: São óxidos onde o nox do oxigênio é -½ (ao invés do comum -2), além de serem formados por esses compostos são formados por metais alcalinos e metais alcalinos terrosos.
A nomenclatura dos superóxidos baseia-se na seguinte regra:
Superóxido + de + nome do elemento que acompanha o oxigênio
Exemplo:
K2O4: Superóxido de potássio
Na2O4: Superóxido de sódio
CaO4: Superóxido de cálcio
MgO4:Superóxido de magnésio
SrO4: Superóxido de estrôncio