Exercício 1 – Reações que liberam gases
Exercício 2 – Eletrólise da água e proporcionalidade
Exercício 3 – Neutralização e estequiometria
Exercício 4 – Volume nas CNTP e nº de moléculas
Exercício 5 – Pureza de reagentes e volume nas CNTP
Exercício 6 – Reação com cálculo de rendimento
Leis ponderais
Descobertas por cientistas como Lavoisier, Dalton e Gay-Lussac, estas ajudam-nos a estabelecer algumas bases para o entendimento das relações de massa ou volume em uma transformação química.
Lei de Lavoisier (Lei da conservação das massas)
Segundo as observações de Antoine Laurent Lavoisier:
“Em um sistema fechado, a massa total dos reagentes é igual à massa total dos produtos”
“Na natureza, nada se perde, nada se cria, tudo se transforma.”
Observe a transformação química abaixo
1/2 O2 + H2 --> H2O
16g + 2g = 18g
Lendo a reação acima: 16g de oxigênio reage com 2g de hidrogênio para produzir 18g de água.
Repare que as massas somadas dos reagentes equivalem à massa do produto. A quantidade e natureza dos átomos são as mesmas, apenas houve um rearranjo/recombinação entre eles.
Esses números seguem uma observação realizada por Lavoisier que é enunciada na forma da Lei de Conservação das Massas, onde nada se perde, nada se cria, tudo se transforma.
Lei de Proust (Lei das proporções fixas)
C + O2 --> CO2
12g de carbono + 32g de oxigênio = 44g de gás carbônico
Analisemos apenas a razão entre as massas de C e O no composto CO2:
12g de carbono / 32g de oxigênio = 2.667g de carbono / 1g de oxigênio
Segundo Proust, esta razão, em massa, é fixa para qualquer quantidade de CO2 analisada. E generalizando, a proporção de massa entre elementos em qualquer composto será fixa para qualquer quantidade avaliada.
Vejamos o caso da H2O:
2g de hidrogênio + 16g de oxigênio = 18g de H2O
Reação mostrada no início do material.
Assim, 16g de O / 2g de H = 8g de O / 1g de H
Segundo Proust, se tivermos 80 g de O em um copo de água pura, podemos afirmar que há 10g de H no recipiente.
Lei de Dalton (Lei das proporções múltiplas)
Essa lei vale para situações onde um par de elementos forma compostos com diferentes proporções do tipo AB, AB2, AB3…
Veja o caso do CO e CO2
A razão de massa entre C e O nesses dois casos é:
Para CO 1.333g de O / 1g de C
Para CO2 2,667g de O / 1g de C
Repare que a segunda razão é 2x a primeira. Ou seja, se compararmos as razões acima, conseguiremos expressá-las como pequenos múltiplos inteiros. Outra afirmação da lei diz que quando elementos se ligam, eles o fazem em uma proporção de pequenos números inteiros.
Lei de Gay-Lussac (Lei volumétrica)
Válida para reações gasosas, estabelece que os volumes entre as substâncias em uma reação, nas mesmas temperatura e pressão, mantêm uma relação volumar constante.
2NH3(g) ⇌ N2(g) + H2(g)
2 volumes de NH3(g) ⇌ 1 volume de N2(g) + 3 volumes de H2(g)
Obs.: 1 mol equivale a um volume.
A relação de volume entre NH3 e N2 é de:
2 volumes de NH3 / 1 volume de N2
Assim, se sabemos que 50 litros de NH3 foram consumidos, inferimos que 25 litros de N2 foi produzido. Isso porque a relação é fixa e se mantém para qualquer volume consumido ou produzido dos componentes da reação.
Grau de pureza
Quando os reagentes não são substâncias puras (Grau de pureza) Em alguns casos na estequiometria os reagentes da reação apresentam em sua composição impurezas, principalmente em reações industriais, ou porque são mais baratos ou porque já são encontrados na natureza acompanhados de impurezas (o que ocorre, por exemplo, com os minérios). Consideremos o caso do calcário, que é um mineral formado principalmente por CaCO 3 (substância principal), porém acompanhado de várias outras substâncias (impurezas). Digamos que tenhamos 100kg do mineral calcário, porém, 90kg são compostos por CaCO 3 , que é o componente principal desse minério e o que necessariamente vai reagir numa reação química qualquer. Sendo assim, dizemos que 90% de todo minério recolhido é CaCO 3 , logo, 10kg são apenas impurezas, que, geralmente, não reagem e não entram no cálculo estequiométrico. Com essa análise chegamos a conclusão que essa amostra de minério tem 90% de pureza, ou seja, dos 100kg que nós recolhemos 90kg serão utilizados.
Sendo assim, define-se: Porcentagem ou grau de pureza é a porcentagem da massa da substância pura em relação à massa total da amostra.
Vejamos um exemplo:
Uma amostra de calcita, contendo 80% de carbonato de cálcio, sofre decomposição quando submetida a
aquecimento, segundo a equação abaixo:
CaCO3 → CaO + CO2
Qual a massa de óxido de cálcio obtida a partir da queima de 800 g de calcita?
Resolução:
O enunciado nos diz que a calcita contém apenas 80% de CaCO3 . Temos então o seguinte cálculo de
porcentagem:
1ª linha) 800 g de calcita _________ 100%
2ª linha) x g de CaCO3 _________ 80% de - Grau de pureza
X = 640g de CaCO3 puro
Note que é apenas essa massa (640g de CaCO3 puro) que irá participar da reação. Assim, teremos o
seguinte cálculo estequiométrico:
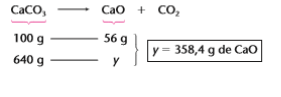
Rendimento
Vamos considerar a reação:
C + O2 → CO2
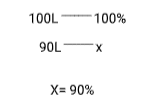
Supondo que deveriam ser produzidos 100 litros de CO2 (CNTP);
vamos admitir também que, devido a perdas, foram produzidos apenas 90 litros de CO2(CNTP), logo o
rendimento foi de 90%.
Em casos assim, dizemos que:
Rendimento é o quociente entre a quantidade de produto realmente obtida em uma reação e a quantidade que teoricamente seria obtida, de acordo com a equação química correspondente.
Exemplo:
Num processo de obtenção de ferro a partir da hematita (Fe2O3), considere a equação balanceada:
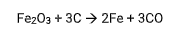
Massas atômicas: C = 12; O = 16; Fe = 56
Utilizando-se 4,8 toneladas (t) de minério e admitindo-se um rendimento de 80% na reação, a quantidade de ferro produzida será de:
a) 2.688 kg
b) 3.360 kg
c) 1.344 t
d) 2.688 t
e) 3.360 t
Resolução: Após o balanceamento da equação, efetuamos o cálculo estequiométrico da forma usual

Gases fora das CNTP
Definimos a equação geral dos gases de Clapeyron para usar em gases que não estejam nas CNTP, ela é dada por:
PV = nRT
Podemos expressar o número de mol (n) da seguinte maneira também:
PV = m/MM RT
Onde:
P = Pressão do gás (atm)
V = Volume do gás (L)
n = Quantidade do gás (mol)
m = Massa do gás (g)
M.M = Massa molar do gás(g)
R = Constante universal dos gases perfeitos (L.atm/mol.K)
T = Temperatura do gás (medida em Kelvin)
Volume molar fora das CNTP (Condições Normais de Temperatura e Pressão)
Definimos que uma substância está fora das CNTP se as condições de temperatura e pressão são diferentes de 0ºC e 1 atm. Quando são usados valores diferentes para esses parâmetros calculamos seu
volume a partir da equação de Clapeyron.
Exemplo:
Dada a reação: Fe2O3(s) + 3CO (g) --> 2Fe (s) + 3CO2(g)
Sabendo que a massa de um mol de ferro é de 56g, calcule a massa de ferro produzida quando 8,2L de CO2 são formados a 2 atm e 127ºC.
Resolução:
Primeiramente amos calcular quantos litros de CO2 são produzidos quando, nas mesmas condições de temperatura e pressão dadas no texto, temos 3 mol do mesmo(quantidade estequiométrica de mol de gás CO2)
PV =nRT
2.V = 3 . 0,082 . 400
V = 49,2L
Assim, quando se produz 2 mol de ferro nas condições dadas eu produzo 49,2L de CO2, com uma regra de três, consigo estabelecer quantas gramas de ferro eu produziria com 8,2L de CO2.
2x56 gramas de ferro ______ 49,2L de CO2
Y gramas de ferro ______ 8,2L de CO2
Y = 18,7g de ferro (aproximadamente)