Quantidade de calor (calor sensível e calor latente)
Processos endotérmicos e exotérmicos
Lei de Hess
Entalpia da reação
Reação global de uma reação de duas etapas
Reações de combustão, liberação de energia e interações interatômicas
Entalpia e volume de gases
Gráfico de Entalpia x coordenada de reação
Produção de metano a partir de gás hidrogênio e grafite
A maior parte das transformações físicas e químicas envolvem perda ou ganho de calor, e ele é sem dúvida a forma mais comum de energia que acompanha as reações químicas. E isso acaba resultando a importância do estudo do calor das reações na físico-química, denominamos termoquímica.
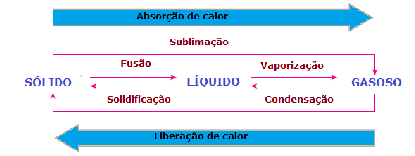
Termoquímica é o estudo das quantidades de calor liberadas ou absorvidas durante as reações químicas.
Para a Termoquímica, as reações químicas se classificam em:
Reações exotérmicas (∆H < 0): São as que produzem ou liberam calor, como por exemplo:
A queima do carvão: C + O2 → CO2 + Calor
A combustão da gasolina: C8H18 + 25/2 O2 →8 CO2 + 9H2O + Calor
Observe que, nesses exemplos, estamos considerando o calor como se fosse um dos “produtos” da reação
Reações endotérmicas (∆H > 0): São as que absorvem calor, como por exemplo:
A decomposição do carbonato de cálcio: CaCO3 + Calor → CaO + CO2
A síntese do óxido nítrico: N2 + O2 +Calor → 2NO
Já nesses caso, veja que estamos considerando o calor como um “reagente” necessário ao andamento da reação.
Existem alguns conceitos básicos, porém importantes, da termoquímica e da calorimetria, como por exemplo:
1) 1 cal é quantidade de energia necessária pra aquecer 1,0 grama de água pura em 1ºC (1 cal = 4,8 kJ)
2) Entalpia (H) é uma grandeza física que mede a energia térmica de um sistema e sua unidade pelo sistema internacional é dado em Joule (J). O rompimento e reagrupamento das ligações nas moléculas que geram esse calor, não há forma de se determinar a entalpia, porém conseguimos determinar com precisão a variação de entalpia (H) que é a medida da quantidade de calor liberada ou absorvida pela reação, a pressão constante.
Gráficos termoquímicos
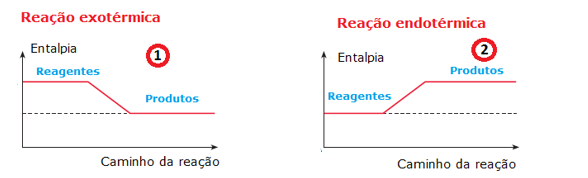
Vemos que o gráfico 1 representa uma reação exotérmica, ou seja, identificamos que a energia dos produtos é menor que a energia dos reagentes, logo houve uma liberação de calor. Em contrapartida, no gráfico 2 percebemos que a energia do produtos é maior do que a energia dos reagentes, logo, houve uma absorção de calor por parte dos reagentes.
Cálculo da variação de entalpia
Na termoquímica, como havíamos dito, não é possível medir a entalpia das substâncias. O que se pode medir e calcular com precisão é a variação de entalpia ao longo das transformações químicas destas substâncias.
Definimos então a variação de entalpia(∆H) algebricamente como:
∆H = Hprodutos - Hreagentes
Considere o seguinte exemplo, com todas as substâncias no estado padrão:
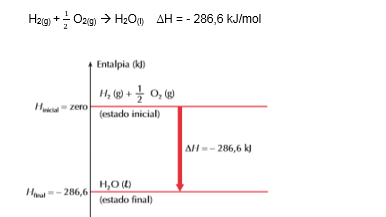
Podemos interpretar o gráfico da seguinte maneira: o H2(g) e o 1/2 O2(g) estão no nível zero, logo tem valor de entalpia igual a zero, pois são substâncias simples e estão no estado padrão.
Analisando o ∆H < 0 , concluímos que a reação é exotérmica e que o sistema em reação perde energia (calor) para o meio ambiente. Consequentemente, o produto final (H2O(l)) ficará em um nível de energia mais baixo (- 286,6 kJ).
Podemos então provar o ∆H dado como:

Esse valor é chamado de entalpia (ou calor) padrão de formação do H2O(l) e é designado por ∆Hf , em que o expoente zero indica o estado padrão, e o índice f indica que se trata da entalpia de formação.
Definimos então:
Entalpia (ou calor) padrão de formação de uma substância é a variação de entalpia verificada na formação de 1 mol da substância, a partir das substâncias simples correspondentes, estando todas no estado padrão.

Lei de Hess
Em meados do século XIX o químico Germain Hess descobriu que a variação de entalpia (ΔH) de uma reação química dependia apenas do estado inicial e do estado final da reação.
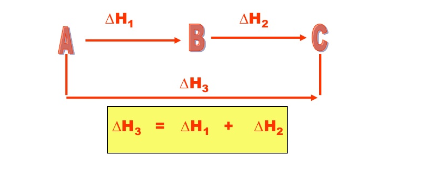
Observe que a entalpia envolvida na transformação de A para C independe se a reação foi realizada em uma única etapa (A→C), ou em várias etapas(A→B→C).
A partir deste conceito chegamos à conclusão de que é possível calcular a variação de entalpia de uma reação através dos calores das reações intermediárias.
Exemplo:
A reação de combustão completa do carbono é representada por:
C+ O2 → CO2
ΔHglobal = ?
Sendo esta a sua reação global com valor de ΔH desconhecido. Porém, sabemos que está equação acontece em duas etapas:
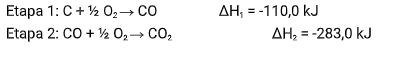
Portanto, conhecendo os valores de ΔH das reações intermediárias, é possível chegar ao valor de ΔH da nossa equação global, somando estas equações intermediárias e cortando os reagentes com produtos
iguais de reações distintas:
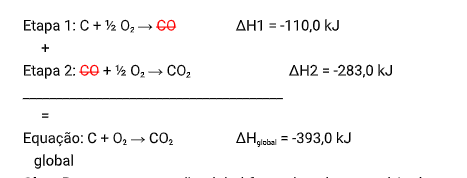
OBS1.: Repare que a reação global formada pelo somatório das etapas tem que ser idêntica a reação global dada pela questão.
OBS2: Caso algumas das reações sejá invertida, é necessario alterar o sinal do ΔH. E caso a reação sejá multiplicada do dividida, deve-se multiplicar o dividir o ΔH também.