Dissolução de diferentes funções inorgânicas
Impacto da chuva ácida no pH
Determinar o pOH da solução-tampão
Concentração de ácido benzoico
Produto de solubilidade de sulfetos
Cálculo do pKps
Concentração de KI na água da chuva
Equilíbrio Iônico
A matéria de equilíbrio químico estuda as reações reversíveis em geral, com as características que são comuns a toda e qualquer reação química. Já o equilíbrio iônico estuda as reações reversíveis que envolvem íons, com suas características específicas, que precisam de fato ser analisadas com maior atenção. Por isso, fez-se esta separação. A partir de agora, vamos olhar para essas particularidades das reações iônicas.
Constante de ionização
Uma das particularidades elementares dessas reações é que se tratam de ionizações (no caso de compostos covalentes, como os ácidos) ou dissociações (no caso de compostos iônicos, como os sais e as bases). Por isso, passamos a chamar a constante de equilíbrio (Kc) de constante de ionização (Ki).
Generalizando, temos que:

Obs: Não calculamos Kp em equilíbrios iônicos, pois este tipo de constante só se aplica a sistemas gasosos, e estamos estudando sistemas aquosos.
Constantes de acidez e basicidade
Em relação à constante de equilíbrio aplicada às reações envolvendo ácidos e bases, também há especificidades para as quais devemos olhar com carinho. Você se lembra da fórmula do Kc, agora Ki?
Kc = [produtos] / [reagentes]
A gente não viu que quanto maior for a concentração dos íons de um ácido ou de uma base, maior será sua força? Então, como os íons, em uma reação de ionização/dissociação, são os produtos, e as moléculas do ácido/da base os reagentes, podemos ver a força desse ácido/dessa base por meio da constante de equilíbrio também. Generalizando, temos que:

Conclusões importantes à beça:
a. Quanto maior a concentração de H+ numa solução de ácido, maior será seu Ki. Logo, quanto maior o Ki de um ácido, maior é a sua acidez. Por este motivo, substituímos o Ki por Ka: constante de acidez.
↑Ka : ↑força do ácido
b. Quanto maior a concentração de OH– numa solução de base, maior será seu Ki. Logo, quanto maior o Ki de uma base, maior é a sua basicidade. Por este motivo, substituímos o Ki por Kb: constante de basicidade.
↑Kb : ↑força da base
Constante do produto de solubilidade (KPS)
Sabemos que cada composto possui um grau ou coeficiente de solubilidade, que é a relação/divisão entre a quantidade do composto em questão(soluto) e a quantidade de água que formam uma solução saturada desse soluto. Ou seja, se a quantidade de soluto pela quantidade de água de uma solução supera a solubilidade desse composto, a quantidade excedente do mesmo se cristaliza e precipita, formando o precipitado, para evitar que a solução fique supersaturada.
O que vamos estudar aqui é o equilíbrio que se estabelece entre os íons dissociados do soluto e o precipitado (íons não dissociados), atingido quando a velocidade de dissolução se iguala à de precipitação. Acontece assim com o cloreto de sódio, por exemplo:
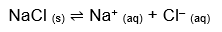
Como todo bom equilíbrio químico, este também tem sua constante, seu padrão que varia com a temperatura: a constante do produto de solubilidade. Para o caso do NaCl, calculamos da seguinte forma:
KPS = [Produtos]
KPS = [Na+][Cl–]
OBS: Sólidos não entram na equação da constante de equilíbrio, lembra disso? Segue a regra. Por isso não temos os reagentes, que nesse caso são sempre sólidos.