Constante de Ionização
Equilíbrio da Amônia - Cálculo do pH
Equilíbrio da Amônia - Teoria de Brønted- Lowry
pH da solução de NaOH
Ácido Orgânico
Calculando Ka e [H ] do Ácido Fórmico
Calculando a Molaridade e o pH de um Ácido HA
Carbonatação do Concreto
Constantes de acidez e basicidade
Em relação à constante de equilíbrio aplicada às reações envolvendo ácidos e bases, também há especificidades para as quais devemos olhar com carinho. Você se lembra da fórmula do Kc, agora Ki?
Kc = [produtos] / [reagentes]
A gente não viu que quanto maior for a concentração dos íons de um ácido ou de uma base, maior será sua força? Então, como os íons, em uma reação de ionização/dissociação, são os produtos, e as moléculas do ácido/da base os reagentes, podemos ver a força desse ácido/dessa base por meio da constante de equilíbrio também. Generalizando, temos que:

Onde:
HA = ácido em solução não ionizado;
H+ = cátion hidrogênio do ácido ionizado;
A– = ânion do ácido ionizado;
BOH = base em solução não dissociada;
B+ = cátion da base dissociada;
OH– = ânion hidroxila da base dissociada;
[ ] = concentração
Hidrólise Salina
Como sabemos, existem ácidos e bases de caráter forte ou fraco, dependendo do seu grau de ionização (no caso dos ácidos) ou de dissociação (no caso das bases). Sabemos, ainda, que a reação de um ácido com uma base gera um sal – com cátion derivado da base reagente e ânion derivado do ácido reagente – e água, conforme vemos na reação genérica abaixo:
HX + YOH --> YX + H2O
Onde:
X = ânion do ácido hipotético HX;
Y = cátion da base hipotética YOH;
YX = sal de cátion Y e ânion X resultante.
Da mesma maneira, ao colocarmos para reagirem um sal e a água, a reação inversa ocorre, gerando novamente o ácido e a base que deram origem a este sal. A essa reação damos o nome de hidrólise salina. A hidrólise do sal YX, por exemplo, seria assim:
YX + H2O ⇌ HX + YOH
Como a força dos ácidos e das bases variam, os sais que deles decorrem também terão graus de acidez e basicidade diversos.
Constante do produto de solubilidade (KPS)
Sabemos que cada composto possui um grau ou coeficiente de solubilidade, que é a relação/divisão entre a quantidade do composto em questão(soluto) e a quantidade de água que formam uma solução saturada desse soluto. Ou seja, se a quantidade de soluto pela quantidade de água de uma solução supera a solubilidade desse composto, a quantidade excedente do mesmo se cristaliza e precipita, formando o precipitado, para evitar que a solução fique supersaturada.
O que vamos estudar aqui é o equilíbrio que se estabelece entre os íons dissociados do soluto e o precipitado (íons não dissociados), atingido quando a velocidade de dissolução se iguala à de precipitação. Acontece assim com o cloreto de sódio, por exemplo:
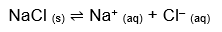
Como todo bom equilíbrio químico, este também tem sua constante, seu padrão que varia com a temperatura: a constante do produto de solubilidade. Para o caso do NaCl, calculamos da seguinte forma:
KPS = [Produtos]
KPS = [Na+][Cl–]
OBS: Sólidos não entram na equação da constante de equilíbrio, lembra disso? Segue a regra. Por isso não temos os reagentes, que nesse caso são sempre sólidos.