Entalpia: Influência da quantidade de reagente e produto
Entalpia: Estado físico dos componentes
Entalpia: Estado físico dos componentes (Exemplo 2)
Entalpia: Influência do estado alotrópico
Entalpia: Influência da diluição/dissolução
Entalpia: Influência da temperatura/ pressão
Fatores que alteram o ΔH de uma reação
O ΔH de uma reação química pode dizer pra gente quanto de energia (calor) é liberada ou abservida pela reação. Podemos classificar a reação como endotérmica ou exotérmica. Mas além disso, nós temos algumas fatores que alteram esse valor de ΔH. Vamos ver alguns exemplos.
a) Quantidade de reagente e produtos
Nós podemos relacionar estequiometricamente a quantidade de calor envolvida na reação com as quantidades de reagentes e produtos.
Exemplo:
2 H2 + O2 --> 2 H2O ΔH = - 485,8 Kj
Analisando esse exemplo, nós podemos pensar o seguinte:
A reação é exotérmica, libera calor, ΔH é negativo. Mas além disso, nós podemos dizer também que 2 mol de H2, pela proporção estequiométrica, liberam nessa reação, 485,8 Kj. A mesma coisa para 1 mol de O2 e 2 mol de H2O. Ou seja, nós podemos relacionar cada um dos participantes, seja reagente ou produto, com a entalpia da reação.
Sendo assim, caso a gente dobre ou divida as quantidades deles, o valor de ΔH irá sofrer essa variação também. Por exemplo se nós dividirmos a reação por 2. Ao invés de termos 2 mol de H2, passarmos a ter 1 mol de H2 apenas.
H2 + ½ O2 --> H2O ΔH = - 242,9 Kj
Alguns problemas vão permitir que a gente relacione os participantes da reação com o ΔH através da regra de 3.
b) Estado físico dos componentes
Para uma mesma substância, se nós mudarmos o seu estado físico, a quantidade de energia será diferente.
OBS: A energia vai aumentando a medida que a gente sai do estado sólido para o líquido e do líquido para o gasoso. Ou seja, nós temos um processo endotérmico, o calor é absorvido. E no caminho inverso, do estado gasoso para o líquido e do líquido para o gasoso, a energia vai diminuindo, sendo assim, o calor vai sendo liberado. Portando nós temos um processo exotérmico.
Nos problemas que envolve mudanças de estados físicos junto de termoquímica, nós podemos pensar como sendo a aplicação da lei de Hess.
Exemplo: Qual o valor da entalpia de vaporização da água?
Dados:
H2(g) + ½ O2(g) --> H2O(l) ΔH = -285,5 Kj
H2(g) + ½ O2(g) --> H2O(g) ΔH = -241,6 Kj
Como nós queremos o ΔH de vaporização, basta considerar que a reação global é H2O(l) --> H2O(g).
Vamos inverter a primeira apenas para que a água no estado líquido fique no reagente.
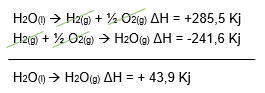
Perceba que o ΔH é positivo, ou seja, reação endotérmica. Confirmando o que nós falamos anteriormente. Mudança do estado líquido para gasoso precisa receber calor, ou seja, absorve calor, processo endotérmico.
Varias manipulações podem aparecer para a gente. Porém a ideia de aplicar a lei de Hess permanece;
c) Estado alotrópico
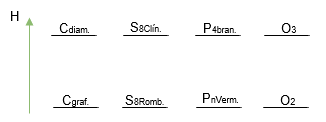
Alotropia: Substância simples diferentes formadas pelo mesmo elemento químico.
Exemplo: O2 e O3; Cgrafite e Cdiamante
Pensando nós estados alotrópicos, é evidente que eles vão possuir energias diferentes. Um deles vai ser mais estável que o outro. Por exemplo, entre o C(graf.) e o C(diam.) a energia do diamante é maior do que a entalpia do grafite.
OBS: A forma alotrópica mais estável possui entalpia igual a zero.
É importante nós sabermos classificar como sendo endotérmico ou exotérmico nas mudanças entre os estados alotrópicos.
No exemplo entre grafite e diamante, como o diamante possui mais energia, para passar do grafite para o diamante, nós precisamos fornecer energia, ou seja, um processo endotérmico, irá absorver energia. E casos a gente queira fazer o inverso, o processo será exotérmico, liberação de energia.
d) Influência da dissolução/diluição
Em umas dissoluções é possível verificar uma variação na temperatura do recipiente. Isso confirma para gente que ocorreu uma liberação ou absorção de calor. Caso o recipiente fica mais quente, quer dizer que a dissolução liberou calor, fazendo com que o fraco fique quente. Ou seja, o processo foi exotérmico. O inverso pode ocorrer também, a dissolução pode absorver calor, fazendo com que o o fraco fique mais frio, caracterizando um processo endotérmico.
Exemplo de dissolução exotérmica:
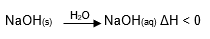
Exemplo de dissolução endotérmica:

OBS: A quantidade de energia liberada ou absorvida está relacionada com a quantidade de água (solvente) na dissolução. Quando mais água (solvente) eu colocar na dissolução, maior será a quantidade de energia liberada ou absorvida. Essa quantidade não é infinita, haverá um limite, onde não adianta colocar mais água (solvente). Pois a energia será a mesma.
e) Temperatura
A temperatura faz com que a entalpia de uma reação mude. Veja esses dois exemplos: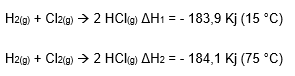
Nesse caso, a reação é exotérmica, sendo assim, o aumente da temperatura faz com que o valor de ΔH aumente um pouco. Isso tem haver com o calor específico de cada um dos participantes.
f) Pressão
Não há alteração significativa no ΔH. Caso a reação não envolva gases, independe da pressão o ΔH será o mesmo. E caso haja a presença de gás, a variação é muito pequena, que nós iremos consideração como nula. Para que esse variação seja relevante, nós precisaríamos de pressões muito elevadas (acida de mil atm), algo que não é comum.