Definindo equilíbrio químico
Influência da temperatura na constante de equilíbrio
Descobrindo se uma reação atingiu o equilíbrio
Constante de equilíbrio em função das pressões parciais
Relação entre Kc e Kp
Equilíbrio químico
Existem reações onde os reagentes e os produtos estão em constante reação em processos opostos, tais reação chamamos de reações reversíveis, que quando com a mesma velocidade de reação em ambos os sentidos atingem o equilíbrio químico.
Exemplo:
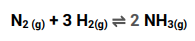
A reação representada acima de produção da amônia(NH3) é uma reação reversível, onde a todo momento temos H2 e N2 reagindo para formar NH3, mas também temos a amônia(NH3) se decompondo e voltando a se tornar H2 e N2. Quando estas velocidades de reação em ambos os sentidos se igualam, dizemos que alcançamos o equilíbrio químico.
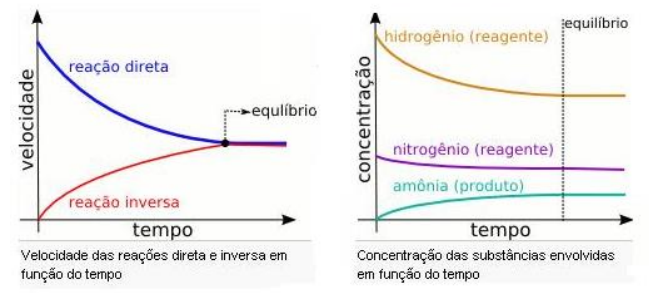
Gráfico de equilíbrio químico:
Psiu!!
No momento em que as velocidades ou concentração se tornam constantes atingimos o equilíbrio químico da reação.
Princípio de Le Chatelier
Sabemos que um sistema que se encontra em equilíbrio – após ter alcançado a igualdade para as velocidades do sentido direto e inverso – tende a permanecer nessa situação. No entanto, quando algum agente externo exerce sua interferência sobre o tal sistema, gerando uma perturbação que o tire da situação de equilíbrio – isto é, faz com que um sentido da reação adquira velocidade maior que a de outro sentido –, o próprio sistema se encarrega de minimizá-la, a fim de voltar ao equilíbrio. Como ele faz isso? Deslocando a reação para um dos sentidos.
A essa “reação” do sistema às perturbações externas, os cientistas deram o nome de Princípio de Le Chatelier, haja vista que foi Henri Louis Le Chatelier, em 1884, quem cunhou o enunciado de tal princípio.
Mas quais são as ações ou perturbações externas que afetam o equilíbrio dos sistemas? A resposta é: concentração, pressão e temperatura.
Importante!
Dos fatores citados acima, o único que tem a capacidade de alterar o valor da constante de equilíbrio (Kc) é a temperatura. Vou te lembrar isso algumas vezes ao longo deste resumo, fique de olho e grave bem.