Velocidade média (parte 1)
Velocidade média (parte 2)
Velocidade média da reação
Interpretação da velocidade média ponto a ponto
Lei de velocidade
Ordem da reação e molecularidade
Cinética Química
Cinética é um termo que denota movimento. Na física, a ciência assim denominada estuda o movimento dos corpos. A cinética química, então, estuda o movimento das reações químicas, ou seja, as velocidades com que elas ocorrem, e ela possui diversas aplicações práticas importantes para o nosso dia a dia: como desacelerar o apodrecimento dos alimentos, como acelerar cozimentos, como produzir com rapidez alguma substância que, de forma natural, levaria muito tempo, etc.
Velocidades das reações
Existem reações que duram segundos e outras que levam anos para se concluírem. Mas como se mede a velocidade com que uma reação ocorre?
Uma reação química, como sabemos, possui reagente(s), que é(são) consumido(s), e produto(s), que é(são) formado(s) ao longo do decorrer da reação. Ou seja, uma reação, num primeiro momento, possui apenas reagente(s), cuja quantidade diminui ao longo do seu decorrer. Após um tempo é que o(s) produto(s) – quantidade inicial igual a zero – começa(m) a aparecer e a ter sua quantidade aumentada ao longo do decorrer da reação.
Se anotamos a hora de início de determinada reação química e, após muito tempo, a quantidade de reagentes for só um pouco menor que a quantidade inicial e a quantidade de produtos for só um pouco maior que a quantidade inicial (zero), entendemos que a reação está ocorrendo de forma lenta. Por outro lado, caso a
variação das quantidades de reagentes e produtos tenha sido grande, entendemos que a reação está rápida. Diante disso, fica claro que o cálculo da velocidade de uma reação consiste no cálculo da velocidade de consumo do(s) reagente(s) ou da velocidade de formação do(s) produto(s).
Velocidade média
A velocidade com que uma reação ocorre não é constante, havendo momentos de maior rapidez e outros de maior lentidão. Por isso, calculamos a velocidade média, que consiste na divisão do quanto uma substância variou por quanto tempo se passou, desde o início da reação até o momento em que a quantidade da tal substância foi contada.

Lei da velocidade
Conhecimentos prévios importantes:
• Reações elementares são aquelas que ocorrem em apenas uma etapa.
Exemplo:
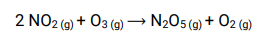
• Reações não elementares são aquelas que ocorrem em duas ou mais etapas, sendo uma lenta e as demais rápidas.
Exemplo:
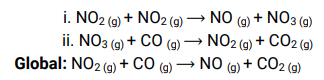
Molecularidade
A molecularidade de uma reação elementar nos indica a quantidade de moléculas que reagiram para formar os produtos da reação. Se na reação ocorre somente o rearranjo ou a decomposição de 1 molécula reagente, ela é unimolecular. Se ocorre choque entre 2 moléculas reagentes, ela é bimolecular. Se ocorre choque entre 3 moléculas reagentes, é trimolecular.
Exemplo:
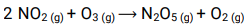
2 moléculas de NO2 mais 1 de O3 → reação trimolecular ou de molecularidade 3.