Exemplo de eletrólise ígnea do MgCl2
Exemplo de eletrólise aquosa
Exemplo de eletrólise aquosa do NaCl
Exemplo de eletrólise aquosa do CuSO4
Exercício de eletrólise ígnea do Cloreto de rádio
Exercício sobre eletrólise aquosa do hidróxido de sódio
Eletrólise, em primeira análise, é o processo que decompõe um eletrólito através da eletricidade. O sufixo “lise” significa “quebra”, “decomposição”, “ruptura”, assim como em hidrólise (decomposição de um composto químico pela água), em pirólise (decomposição de um composto químico pelo fogo ou altas temperaturas), em hemólise (quebra ou ruptura da hemácia), etc.
O que é eletrólito?
Não se lembra? Aqueles compostos que conduzem eletricidade quando fundidos (no caso dos compostos iônicos) ou em solução aquosa (no caso de compostos iônicos e de ácidos, que se ionizam em água, mesmo sendo covalentes), por gerarem íons.
A eletrólise consiste no processo eletroquímico que, ao contrário da pilha, converte energia elétrica em energia química. Como assim? Simples, usa-se a eletricidade – corrente elétrica – para promover uma reação de oxirredução, por meio da qual se produzem substâncias químicas a partir de outras. Vejamos suas principais características:
• Ocorre em sistemas líquidos: eletrólitos fundidos, quando for eletrólise ígnea, ou em solução aquosa, quando for eletrólise aquosa.
• Ao contrário da pilha novamente, ocorre de maneira não espontânea, ou seja, é necessário um gerador (pilha) para forçar a reação redox a ocorrer, forçar as espécies envolvidas a reduzirem ou oxidarem. Isso já nos diz algo muito importante: se a espécie que se reduz não o faz naturalmente, é porque seu potencial de redução não é superior ao da outra; da mesma maneira, se a espécie que se oxida não o faz naturalmente, é porque seu potencial de oxidação não é superior ao da outra. Logo, na eletrólise:

Onde:
E°red = potencial de redução de quem reduziu;
E°oxi = potencial de oxidação de quem oxidou;
E°red menor = potencial de redução de quem reduziu, pois, na eletrólise, quem reduz é quem tem menor potencial de redução;
E°red maior = potencial de redução de quem oxidou, pois, na eletrólise, quem oxida é quem tem maior potencial de redução.
• Sendo assim, o fluxo de elétrons é inverso na eletrólise, isto é, vai do polo positivo para o polo negativo, também ao contrário do que ocorre na pilha.
• Os eletrodos são inertes, isto é, não reagem, não fazem parte da reação redox, não oxidam nem reduzem. Estão ali apenas para fazerem a transferência de elétrons do agente redutor para o agente oxidante. Geralmente as substâncias usadas como eletrodos são platina e grafita (tipo de carvão).
• O cátodo é onde ocorre a redução dos cátions, ou seja, os cátions recebem elétrons e ficam neutros (NOX = 0); o ânodo é onde ocorre a oxidação dos ânions, ou seja, os ânions perdem elétrons e ficam neutros (NOX = 0). Sendo assim, vemos que o fluxo de elétrons, também na eletrólise, vai do que oxida para o que reduz, do ânodo para o cátodo. Então, como vimos que também ocorre do polo positivo para o negativo, concluímos que o ânodo será o polo positivo (de onde os elétrons partem) e o cátodo será o polo negativo (para onde os elétrons vão), o que é oposto à pilha. Olha só: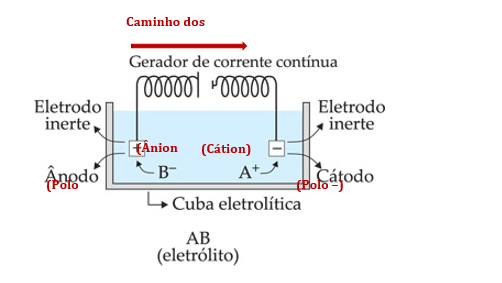
Eletrólise ígnea
O esquema exposto acima representa com perfeição uma eletrólise ígnea, em que sempre o ânion do eletrólito (B–) sofre oxidação e o cátion do eletrólito (A+) sofre redução. Mas por quê? Porque nesse tipo de eletrólise o eletrólito se encontra fundido e não dissolvido em água; o sistema é um líquido puro. Assim, os únicos íons possíveis nesse tipo de sistema são os que compõem a molécula do eletrólito.
Exemplo: eletrólise ígnea do cloreto de sódio (NaCl).
Ao fundir-se o eletrólito, os íons se dissociam, segundo a reação:
NaCl (l) Δ→ Na+ (l) + Cl− (l)
Ao ligarmos um gerador associado ao fio externo que conecta os eletrodos inertes, o fluxo de elétrons se inicia, do polo positivo ao polo negativo, oxidando o ânion Cl− e reduzindo o cátion Na+, o que produz as formas neutras de cada um desses íons (Cl2(g) e Na°(s)), seguindo as equações:
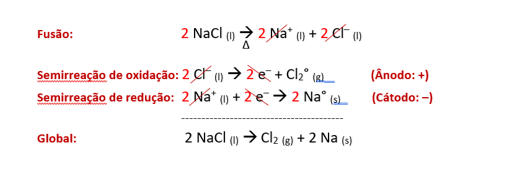
Com isso, vê-se a borbulhação desse sistema nas proximidades do ânodo inerte, porquanto há gás cloro sendo formado, ao mesmo tempo em que o sódio metálico vai ficando aderido ao cátodo inerte.
Eletrólise aquosa
Aqui, nem sempre os íons do eletrólito sofrem a reação redox, uma vez que ele está dissolvido em água – solução aquosa –, a qual sofre autoionização, gerando cátions H^++ e ânions OH^-−, lembra? Dessa forma, a solução conterá os cátions H^++ e os do soluto (A^++) e os ânions OH^-− e os do soluto (B^-−). Então, quem sofre oxidação e redução?Experimentos mostraram aos químicos que, na concorrência entre os cátions pela redução, há uma prioridade de descarga entre eles. Mostraram também que o mesmo ocorre com os ânions, na concorrência pela oxidação, e mostraram, ainda, que as prioridades são de acordo com a seta:
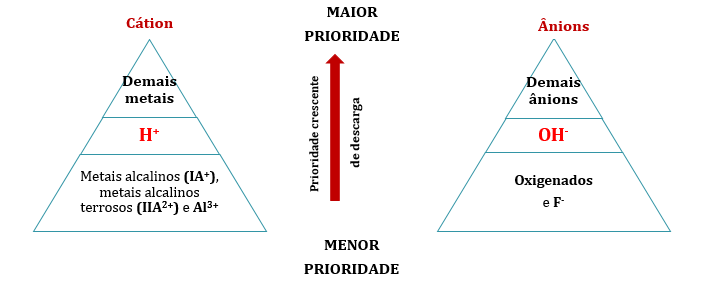
Exemplo: eletrólise aquosa do cloreto de sódio (NaCl).
Ao dissolvermos o NaCl em água, ocorrem a dissociação do eletrólito e a autoionização da água, segundo as reações
NaCl (aq) 🡪 Na+ (aq) + Cl−(aq)
H2O (l) 🡪 H+ (aq) + OH− (aq)
Ao ligarmos o gerador, o fluxo de elétrons se inicia, mais uma vez do polo positivo ao polo negativo, induzindo a reação redox.
Entre os cátions dissolvidos, é o H+ que ganha a competição pela redução, já que tem prioridade de descarga sobre o Na+, que pertence à família IA da tabela periódica e, portanto, está “abaixo” na pirâmide. Sua semirreação de redução ocorre assim
2 H+ (aq) + 2 e− 🡪 H2(g)
Entre os ânions dissolvidos, é o Cl− que ganha a competição pela oxidação, já que tem prioridade de descarga sobre o OH−, pois, por ser não oxigenado, está “acima” na pirâmide. Sua reação de oxidação já conhecemos, pelos exemplos anteriores. Assim, somamos todas as equações químicas para chegarmos à global:
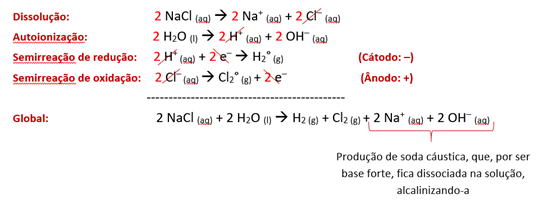
Com isso, vê-se o borbulhamento desse sistema nas proximidades do ânodo inerte, porquanto há gás cloro sendo formado, e também nas proximidades do cátodo inerte, porquanto há gás oxigênio sendo formado.
Exemplo 2: eletrólise aquosa do sulfato de cobre (CuSO4).
Ao dissolvermos o NaCl em água, ocorrem a dissociação do eletrólito e a autoionização da água, segundo as reações:
CuSO4 (aq) 🡪 Cu2+ (aq) + SO4 2− (aq)
H2O (l) 🡪 H+ (aq) + OH– (aq)
Ao ligarmos o gerador, o fluxo de elétrons se inicia, mais uma vez do polo positivo ao polo negativo, induzindo a reação redox.
Entre os cátions dissolvidos, é o Cu+ que ganha a competição pela redução, já que tem prioridade de descarga sobre o H+, pois, por não pertencer às famílias IA e IIA está “acima” na pirâmide. Sua semirreação de redução ocorre assim
Cu2+ (aq) + 2 e−🡪 Cu° (s)
Entre os ânions dissolvidos, é o OH− que ganha a competição pela oxidação, já que tem prioridade de descarga sobre o SO4 2−, que, por ser oxigenado, está “abaixo” na pirâmide. Sua semirreação de oxidação ocorre assim:
2 OH−(aq) 🡪 H2O (l) + ½ O2 (g) + 2 e−
Assim, somamos todas as equações químicas para chegarmos à global:
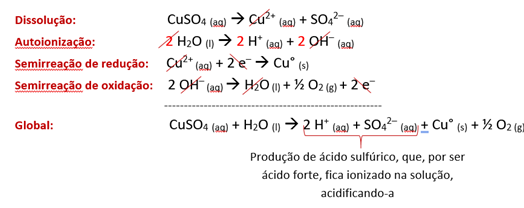
Com isso, vê-se o borbulhamento desse sistema nas proximidades do ânodo inerte, porquanto há gás oxigênio sendo formado, ao mesmo tempo em que o cobre metálico vai ficando aderido ao cátodo inerte.