Questão 1 - purificação do cobre
Questão 2 - galvanização
Questão 3 - eletroquímica e recuperação de objetos oxidados
Questão 4 - corrosão do eletrodo ativo
Questão 5 - galvanização e sua reação global
Questão 6 - eletrólise do sulfato de cobre
Em qualquer eletrólise, os eletrodos devem, evidentemente, ser bons condutores de eletricidade; isso nos obriga a utilizar eletrodos metálicos ou de grafite. Por outro lado, o eletrodo pode sofrer corrosão devido à passagem da corrente elétrica ou devido às substâncias formadas na eletrólise.
O eletrodo de grafite, por exemplo, resiste a quase tudo, exceto ao oxigênio, pois, sendo uma
variedade de carbono, ele sofre oxidação na presença de oxigênio:
C (grafite) + O2 → CO2
Os eletrodos metálicos funcionam bem na posição de catodo. Na posição de anodo, porém, o
metal pode ser rapidamente corroído, ou melhor, pode participar da própria eletrólise, uma vez que:
• o anodo é um oxidante poderoso;
• os metais (Me) têm uma tendência natural de perder elétrons (oxidação):
Me → Me+ + e-
Chega-se então a uma situação extrema, na qual o anodo ou polo positivo “prefere” retirar
elétrons do próprio metal que o constitui, em vez de descarregar os ânions existentes em solução;
desse modo, o próprio anodo vai sendo desgastado ou corroído.
Aliás, essa situação é bastante comum; praticamente todos os metais acima do cobre (E0 = +0,34 V)
na tabela dos potenciais-padrão de eletrodo irão sofrer oxidação eletrolítica se forem colocados como
anodo em uma célula eletrolítica. Nesses casos, diremos que o eletrodo é não inerte ou ativo, uma vez que
ele está tomando parte na reação de eletrólise.
Exemplo — eletrólise de H2SO4 em solução aquosa diluída, com eletrodos de cobre
Na solução aquosa, temos as seguintes ionizações:
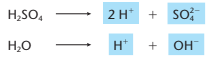
O polo negativo tem como única opção a descarga do H+. Já o polo positivo, poderia optar por tirar elétrons ou do SO42-, ou OH-, ou agora do próprio ânodo (metal cobre). Segundo a equação Cu → Cu2+ + 2 e-. Como essa oxidação é mais fácil, ela será sem dúvidas preferida.
Teremos, então, o esquema:
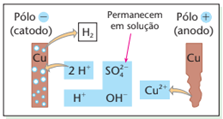
Reações da eletrólise
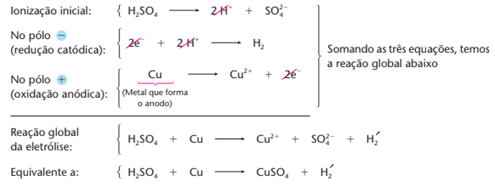
Esquematicamente:
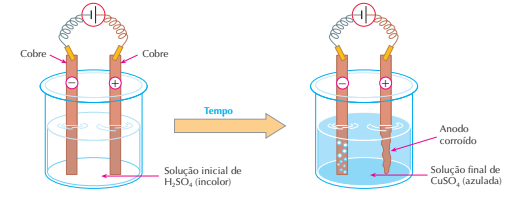
É interessante notar que a reação Cu + H2SO4 → CuSO4 + H2 é espontânea.
O Cu, estando abaixo do H na tabela de potenciais-padrão de eletrodo, não pode deslocar o H+ dos
ácidos; no entanto aqui a reação se efetuou, pois foi forçada a isso pela passagem da corrente elétrica.
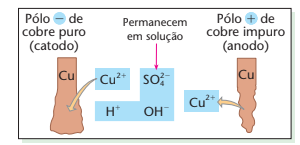
Exemplo - eletrólise de CuSO4 em solução aquosa, com anodo de cobre impuro e catodo de cobre puro.
Reações de eletrólise:
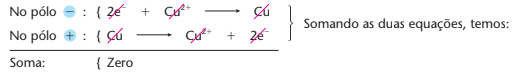
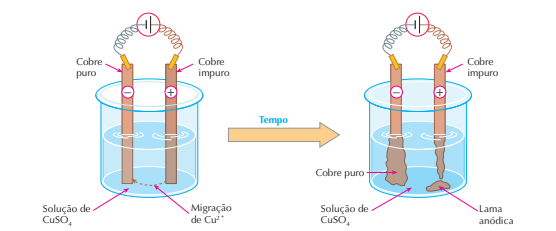
Nesse caso, a corrente elétrica apenas transporta cobre puro do anodo para o catodo; as impurezas existentes no anodo ou ficam em solução, ou precipitam, formando a chamada lama anódica. Esse processo é chamado refino eletrolítico e permite obter cobre com pureza da ordem de 99,9%, que é chamado cobre eletrolítico e é indispensável à fabricação de fios elétricos (as impurezas diminuem exageradamente a condutividade elétrica dos metais). Embora dispendioso, o refino eletrolítico é o melhor método de purificação dos metais. Além do cobre, também o zinco, o chumbo e outros metais são, atualmente, purificados por esse processo.