Diluição
Exercício de diluição
Mistura de soluções com o mesmo soluto
Exemplo de mistura de solução com o mesmo soluto
Mistura de soluções - solutos diferentes sem reação química
Diluição
Comumente, em nosso dia-a-dia, realizamos a diluição de soluções, isto é, acrescentamos a elas um pouco de solvente, geralmente água, a solutos, que podem ser sucos concentrado, inseticidas, tintas…entre outros.
Concluindo: Diluir uma solução significa adicionar a ela uma porção do próprio solvente puro.
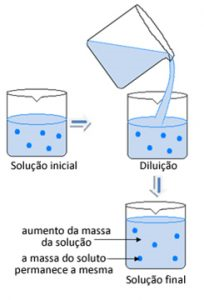
Numa diluição a massa do soluto não se altera, apenas o volume do solvente. Partindo disso temos a concentração da solução inicial expressa por:
Ci = mi / Vi --> mi = Ci . Vi
E a concentração da solução após a diluição como:
Cf = mi/ Vf --> mi = Cf . Vf
Como as massas são iguais antes e depois da diluição chegamos a expressão que:
Ci . Vi = Cf . Vf
Essa fórmula nos mostra que, quando o volume aumenta (de Vi para Vf), a concentração diminui (de Ci para Cf) na mesma proporção, ou seja:
O volume e a concentração de uma solução são inversamente proporcionais.
Exemplo: Para uma solução de 200 ml de NaCl na concentração 0,4 mol/L, qual o volume de água final para que a concentração caia a metade?
Cf = 0,4/2 = 0,2 mol/L
Ci.Vi = CfVf
0,4.200 = 0,2 . Vf
Vf = 400 mL de água
Misturas de soluções de uma mesmo soluto
Vamos imaginar duas soluções (A e B) de cloreto de sódio (NaCl), como ilustrado abaixo. Na solução final (A + B), a massa do soluto é igual à soma das massas dos solutos em A e B.
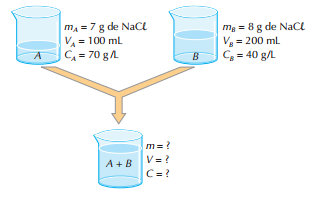
Portanto: m = 7 + 8 ⇒ m = 15 g de NaCl
O volume da solução também é igual à soma dos volumes das soluções A e B. Portanto:
V = 100 + 200 ⇒ V = 300 mL de solução Com esses valores e lembrando a definição de concentração, obtemos, para a solução final (A + B):
300 mL de solução ---------- 15 g de NaCl
1.000 mL de solução -------- C
OU
C = m = 15 g = 50 g/L
V 0,3 L
Cfinal = 50 g/L
Obs: É interessante notar que a concentração final (50 g/L) terá sempre um valor compreendido entre as concentrações iniciais (70 g/L > 50 g/L > 40 g/L).
podemos generalizar esse tipo de problema, da seguinte maneira:
• massa do soluto na solução A: ma = Ca.Va
• massa do soluto na solução B: mb = Cb.Vb
• massa do soluto na solução final: m = CV
Como as massas dos solutos se somam (m = ma + mb ), temos:
Exemplo:
200 mL de uma solução a 0,2 mol/L de KBr é misturada a 100mL de uma solução de mesmo soluto com concentração igual a 0,4 mol/L. Qual a concentração da mistura obtida?
Solução 1
V = 200 mL
M = 0,2 mol/L
Solução 2
V = 100 mL
M = 0,4 mol/L
Solução final
Vf = V1 + V2
Vf = 200 + 100
Vf = 300 mL
M1 . V1 + M2 . V2 = Mf . Vf
0,2 . 200 + 0,4 . 100 = Mf . 300
Mf = 0,27 mol/L de KBr.
Mistura de duas soluções de solutos diferentes que não reagem entre si
Supondo que tenhamos soluções A e B, a primeira, uma solução de NaCl, e a segunda, de KCl.
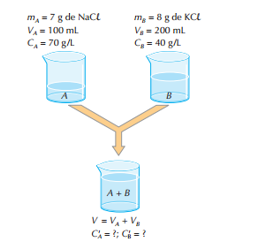
O volume da solução final (A + B) será: V = VA + VB. Nela reaparecerão inalterados os solutos NaCl e KCl, pois eles não reagem entre si e como os solutos não reagem, cada soluto vai ser tratado de forma independente, logo, podemos aplicar as fórmulas da diluição nesse tipo de mistura.
para o NaCl: VA . CA = V.C’A ⇒ 100 . 70 = 300 . C’A ⇒ C’A ≈ 23,3 g/L
para o KCl: VB . CB = V.C’B ⇒ 200 . 40 = 300 . C’B ⇒ C’B ≈ 26,6 g/L
Exemplo:
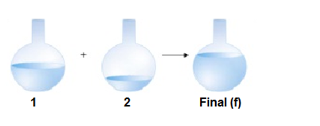
Frasco 1:
n= 0,1 mol de NaCl
V = 200 mL
Frasco 2:
M = 0,2 mol de CaCl2
V = 300 mL
Qual a concentração final dos íons Na+, Ca+2 e Cl− após misturarmos os conteúdos dos frascos 1 e 2.
Frasco 1: NaCl
NaCl → Na+ + Cl-
1mol 1mol 1mol
0,1mol 0,1mol 0,1mol
Temos então no frasco 1:
0,1 mol de Na+ e 0,1 mol de Cl-
Frasco 2: CaCl2
CaCl2 → Ca+2 + 2Cl−
1mol 1mol 2mol
0,2mol 0,2mol 0,4mol
Temos então no frasco 2:
0,2 mol de Ca+2 e 0,4 mol de Cl−
No frasco final, após a mistura de 1 e 2:
Vfinal = 200mL + 300mL = 500mL = 0,5L
Concentração final:
Para Na+
n = 0,1 mol
V = 0,5L
M = n / V(L) → M = 0,1 / 0,5 → M = 0,2 mol/L de Na+
Para Ca+2
n = 0,2 mol
V = 0,5L
M = n / V(L) → M = 0,2 / 0,5 → M = 0,4 mol.L-1 de Ca+2
Para Cl^-− (íon comum as duas soluções misturadas)
n1 + n2 = nf → 0,1 + 0,4 = 0,5 mol
V = 0,5L
M = n / V(L) → M = 0,5 / 0,5 → M = 1 mol/L de Cl−