Teoria das colisões
Complexo ativado e energia de ativação
Fator 1: superfície de contato
Fator 2: temperatura
Fator 3: concentração dos reagentes
Fator 4: catalisador e inibidor
Fatores que alteram a velocidade de reação
Realizada a reação entre as substâncias como vimos anteriormente, existem alguns fatores que podemos alterar para que essas reações ocorram com maior velocidade.
Superfície de contato
A superfície de contato entre os reagentes altera a velocidade reacional, se aumentamos a superfície de contato a velocidade de reação também é aumentada, pois haverá uma maior quantidade de colisões efetivas entre os reagentes.
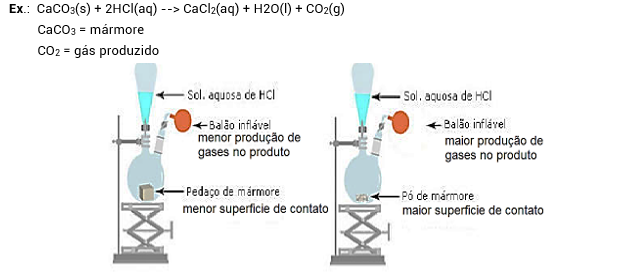
No mármore em pó teremos uma maior velocidade reacional, pois temos maior superfície de contato entre os reagentes.
Ex2: Colocando para reagir com a mesma quantidade de água um comprimido efervescente inteiro e um triturado.

Devido a maior superfície de contato no comprimido triturado, a reação irá terminar primeiro.
Temperatura
Para a influência da temperatura na velocidade das reações químicas teremos que analisar o quanto a temperatura foi aumentada.
O aumento da temperatura tende a aumentar a velocidade da reação, pois aumenta a energia cinética das moléculas, aumentando assim a quantidade de colisões efetivas.
Atenção: Fator de Van’t Hoff - Um aumento de 10ºC na temperatura do sistema, irá duplicar a velocidade da reação.
Ex: Quando colocamos um alimento para ser preparado numa panela de pressão. Com o aumento da pressão, aumenta também a temperatura, fazendo com que o alimento cozinha mais rapidamente. Outro exemplo, seria o processo inverso, diminuir a temperatura para poder reduzir a velocidade de uma reação, isso ocorre quando colocamos uma carne no freezer para conserva-la por mais tempo.
Concentração
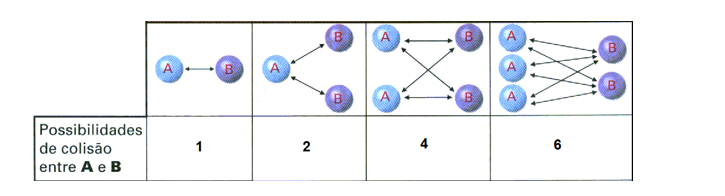
O aumento da concentração dos reagentes faz com que a quantidade de partículas dos reagentes seja maior, causando assim maior probabilidade de um reagente encontrar o outro reagente e colidir de forma efetiva, ocasionando a reação.
Catalisador
Os catalisadores são substâncias que quando colocadas no meio reacional fazem com que a reação forme um novo complexo ativado. Esse novo complexo ativado (intermediário reacional) tem menor energia de ativação, fazendo a reação proceder com maior velocidade.
Exemplo:
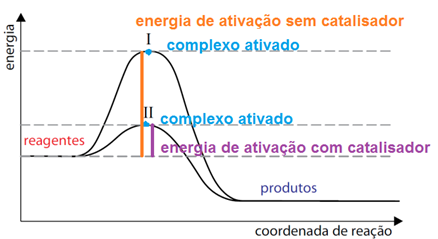
Curva da Reação I - sem catalisador - maior energia de ativação - maior velocidade de reação.
Curva da Reação II - com catalisador - menor energia de ativação - menor velocidade de reação.
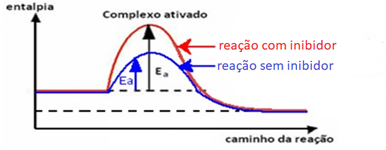
Inibidores
Os inibidores, venenos ou anticatalisadores funcionam de forma oposta a do catalisador, pois eles aumentam a energia de ativação das reações em que estão presentes e consequentemente reduzem as velocidades de reação. Essa substância reduz e até destrói a ação do catalisador.
Exemplo:
2 H2O2(aq) → 2 H2O(l) + 1 O2(g)
Na reação de de decomposição da água oxigenada demostrada acima um inibidor que pode ser usado é um ácido, pois quando o meio está ácido, a reação se processa de forma mais lenta.