Casos particulares de estequiometria: Reações consecutivas e limitante e excesso - Parte 1
Casos particulares de estequiometria: Reações consecutivas e limitante e excesso - Parte 2
Casos particulares de estequiometria: Reações consecutivas e limitante e excesso - Parte 3
Casos particulares de estequiometria: Reações consecutivas e limitante e excesso - Parte 4
Casos particulares de estequiometria: Reações consecutivas e limitante e excesso - Parte 5
Casos particulares de estequiometria: Reações consecutivas e limitante e excesso - Parte 6
Casos particulares de estequiometria: Reações consecutivas e limitante e excesso - Parte 7
Reação com reagente em excesso ou limitante
Toda reação química ocorre de acordo com a proporção estequiométrica constante, indicada pelos seus coeficientes.
Porém, em alguns casos, teremos um dos reagentes sendo totalmente consumidos e outro com excesso(sobra) no final da reação.
O reagente totalmente consumido neste tipo de reação é chamado reagente limitante. E o reagente com “sobra” será chamado reagente em excesso.
Exemplo 1:
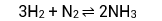
Possui proporção estequiométrica de:
3 mols H2 + 1 mol de N2 ⇌ 2 mols de NH3
Proporção: 3 : 1 : 2
Se quiser produzir o triplo de NH3, precisamos manter a proporção:
9 mols H2 + 3 mols de N2 ⇌ 6 mols de NH3
Proporção: 9 : 3 : 6
No entanto, se estiver reagindo:
6 mols H2 + 4 mols de N2 ⇌ 4 mols de NH3
Proporção dada: 6 : 4 : 4 - A reação possui mais N2 do que o necessário.
Proporção correta: 6 : 2 : 4
O N2 está em excesso: 2 mols de excesso
O H2 é o reagente limitante, pois é totalmente consumido.
Exemplo 2:
Qual o reagente em excesso e qual o reagente limitante quando reagimos 128g de SO2 com 48g de O2. Massa molar: S = 32g/mol, O = 16g/mol.
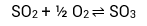
Possui proporção estequiométrica de:
1 mol SO2 + ½ mol de O2 ⇌ 1 mol de SO3
Proporção em mol: 1 : ½ : 1
Proporção em massa: 64g : 16g : 80g
Se quiser reagir 128g de SO2 com 48g de O2, precisamos manter a proporção:
64g de SO2 reage com 16g de O2
128g (2 x 64) de SO2 reagiria também com o dobro de O2, 32g.
Como se pode observar os 128g de SO2 reagem, portanto ele é o reagente limitante.
E somente 32g de O2 precisam reagir para consumir toda a massa de SO2 e como temos 48g de O2, 16g do mesmo estão em excesso, ou seja, 16g de O2 não reagem (sobram).
Reações consecutivas
Para que seja possível relacionar substâncias que dão sequência a reações consecutivas, é preciso que haja uma substância comum entre elas. Sendo assim, será possível determinar coeficientes comum entre essas equações.
São reações consecutivas, por exemplo:
S8 + O2 → SO2
SO2 + ½ O2 → SO3
SO3 + H2O → H2SO4
Nota-se que o SO2 é comum a equação 1 e 2, e o SO3 é comum a equação 2 e 3. Sendo possível criar uma relação entre as três equações.
Sendo assim, para cada 8 mols de S8 pode-se produzir quantos mols de H2SO4?
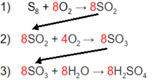
Exemplo:
Qual a massa de CO2 produzida pela queima de 36g de C com excesso de O2.
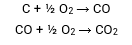
Pela estequiometria da reação sabemos que:
12g de C produz 28g de CO, e 28g de CO produz 44g de CO2.
Logo,
36g (3 x 12g) de C produz 84g (3 x 28g) de CO, e 84g de CO produz 144g (3 x 44g) de CO2. Mantendo assim a proporção existente entre as equações intermediadas pelo CO.