Cisão de ligações - Cisão homolítica e heterolítica
Definindo uma reação de adição
Hidrogenação catalítica
Halogenação
Halogenação a alcadieno conjugado
Hidro-halogenação e Regra de Markovnikoff
Regra anti-Markovnikoff (efeito Kharasch)
Hidratação
Mecanismo de adição heterolítica e radicalar
Cisão de ligações, reação de adição em alcenos e alcinos
Nós já conhecemos, em geral, como as reações com compostos inorgânicos ocorrem, bem como os mecanismos que utilizam e a forma das equações que as representam. Na química orgânica, já que a variedade de funções existentes neste ramo é muito maior que na inorgânica, a quantidade de tipos de reação também é muito maior.
Para nos ajudar a organizar esse universo de especificidades, dividiu-se as reações orgânicas em 4 TIPOS GERAIS, dos quais se desmembram todos os tipos mais específicos:
• Reações de adição
• Reações de substituição
• Reações de eliminação
• Reações de oxidação
Cisão de ligações
Em toda reação química, há um rearranjo de átomos para a formação de novos compostos a partir dos reagentes. Para que tal rearranjo ocorra, as ligações existentes entre eles nos compostos reagentes precisam ser rompidas, ao que damos o nome de cisão. Esta cisão pode ser de 2 formas possíveis:
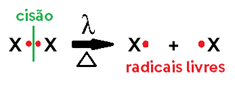
Homolítica
• Neste caso, a quebra ocorre no meio da ligação, sendo IGUAL para ambos os átomos (por isso o prefixo “homo”), já que cada grupo liberado fica com um dos elétrons do par anteriormente compartilhado;
• Estes grupos com valência livre são chamados de radicais livres, motivo pelo qual podemos chamar as reações com cisão homolítica de RADICALARES ou reações por VIA RADICAL LIVRE;
• Ocorrem com catalisadores que podem ser a LUZ (λ ou hƒ), CALOR (Δ), PERÓXIDO (H2O2) ou CATALISADORES DE SUPERFÍCIE (Pt, Ni, Pd).
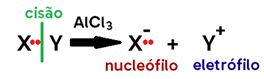
• Neste caso, a quebra não ocorre no meio da ligação, sendo DESIGUAL (por isso o prefixo “hetero”), já que um grupo liberado fica com os 2 elétrons do par anteriormente compartilhado e o outro grupo perde os elétrons daquela ligação;
• Estes grupos com carga formados são ÍONS. O que tiver com falta de elétron (carga positiva) vai ser atraído, na formação de um novo composto, por espécies carregadas negativamente (elétrons), e por isso chamamo-lo de ELETRÓFILO (E+); já o que tiver com sobra de elétron (carga negativa) vai ser atraído por espécies carregadas positivamente (prótons, que ficam no núcleo do átomo), e por isso chamamo-lo de NUCLEÓFILO (Nu–);
• Ocorrem com catalisadores que podem ser ÁCIDOS, BASES, SAIS, ÁGUA ou ÁCIDOS DE LEWIS (AlCl3, FeBr3, BF3).
Sendo assim, as reações podem apresentar 3 diferentes MECANISMOS DE REAÇÃO:
Via radicais livres --> em que um radical livre ataca uma ligação covalente enfraquecida;
Via reação nucleofílica --> em que uma espécie nucleófila é a primeira a atacar o composto orgânico;
• Ocorre quando o composto orgânico que sofre a reação possui carbono com carga positiva (ou seja, ligado a um elemento muito eletronegativo). Portanto, a ligação atacada deve ser em carbonila (aldeídos, cetonas, ácidos carboxílicos e ésteres), em carbono ligado a hidroxila (álcoois) e em carbono ligado a halogênio (haleto orgânico).
Via reação eletrofílica --> em que uma espécie eletrófila é a primeira a atacar o composto orgânico.
• Ocorre quando o composto orgânico que sofre a reação é insaturado (alcenos, alcinos, alcadienos, cicloalcanos e aromáticos) e a ligação atacada é justamente a dupla/tripla, pois dupla/tripla ligação é uma nuvem de elétrons, atraindo espécies eletrófilas.
Reações de Adição em alcenos e alcinos
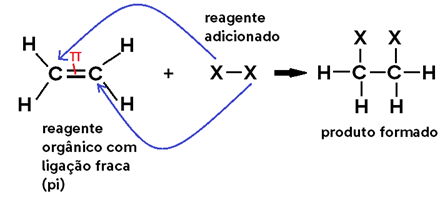
Falando de uma forma genérica, as reações de adição ocorrem quando ADICIONAMOS um reagente (geralmente inorgânico) a um composto orgânico, formando um único produto.
Para que isso ocorra, é necessário sempre haver uma LIGAÇÃO ENFRAQUECIDA NO REAGENTE ORGÂNICO, a qual se rompe, abrindo 2 valências livres. Ao mesmo tempo, o outro reagente adicionado ao orgânico também sofre uma cisão, e cada uma de suas partes se liga a uma valência livre do reagente orgânico.
Veja o caso geral abaixo, em que a ligação fraca é uma LIGAÇÃO PI:
Importante à beça:
Quando o composto for ALCADIENO CONJUGADO (ou seja, em que 2 ligações duplas são intercaladas por 1 ligação simples) e participar de uma reação de adição incompleta (com 1 mol de reagente com fórmula genérica X2), ocorrerá a chamada REAÇÃO 1,4, através da qual o produto formado em maior proporção sempre terá uma ligação dupla no lugar da ligação simples que intercalava as duplas no alcadieno reagente.
Veja:
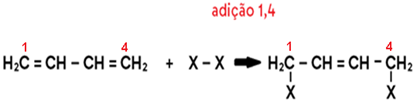
Agora veja outro caso geral, em que a ligação fraca é uma LIGAÇÃO TENSIONADA EM CADEIA FECHADA:
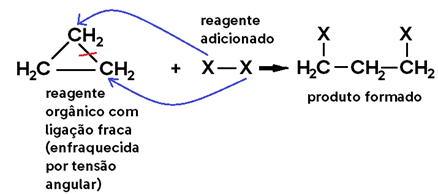
• OPA, tensão angular?
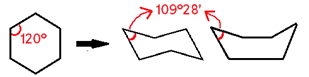
Essa teoria é chamada de “Teoria das tensões de Bayer”. Entenda: todos os carbonos dos ciclanos, por serem compostos cíclicos com ligações simples, possuem hibridização sp³, cujos ângulos entre os pares eletrônicos (geralmente nas ligações) devem ser 109°28’ para haver estabilidade, devido à geometria tetraédrica. No entanto, compostos de cadeia fechada possuem geometria que segue o padrão dos polígonos regulares, cada um com seus ângulos internos.
Exemplo: Ciclopropano -> possui geometria triangular, cujos ângulos internos são 60°, valor bem distante de 109°28’. Isso que gera uma tensão angular nessas ligações que as torna fracas, mais suscetíveis à ruptura.
OBS: O ciclo-hexano sofre deformação em sua estrutura, adquirindo forma de bote/barco ou de cadeira, nas quais o ângulo, em vez de 120° (ângulo interno do hexágono), é 109°28’. Essa deformação angular compensa a tensão angular, e a ligação entre os átomos de carbono deixa de ser fraca. Logo, não há tensão angular em anéis com 6 ou mais carbonos.
Hidrogenação catalítica
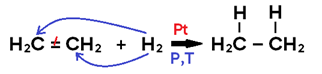
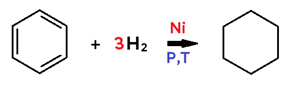
• Ocorre com ADIÇÃO DE H2 ao alceno, alcino, cicloalcano ou benzeno;
• Utiliza placa metálica de Pt, Ni ou Pd, que adsorve o H2, funcionando como CATALISADOR DE SUPERFÍCIE;
• Só ocorre sob TEMPERATURA E PRESSÃO ELEVADA;
• Em alceno, o produto formado é um alcano;
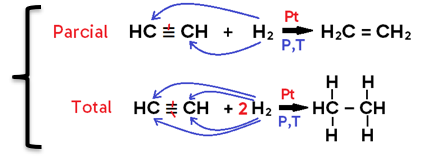
• Em alcino, o produto formado pode ser um alceno (caso se adicione 1 mol de H2, o que configura uma hidrogenação PARCIAL) ou um alcano (caso se adicionem 2 mols de H2, o que configura uma hidrogenação TOTAL);
• Em cicloalcano, o produto formado é um alcano;
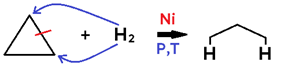
Em benzeno, assim como em alceno e alcino, cada mol de H_2H2 provoca a ruptura de 1 ligação pi, podendo formar cicloalceno ou cicloalcano.
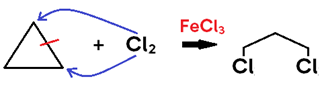
Halogenação
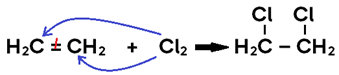
• Ocorre com ADIÇÃO DE Cl2, Br2 ou I2 (halogênios moleculares, genericamente: X2) ao alceno, alcino ou cicloalcano;
OBS: F2 é tão reativo que gera uma reação explosiva, a qual não produz haletos; a reação com o I2 é muito lenta, motivo pelo qual quase não ocorre. Conclusão: vamos tomar como exemplos apenas cloração e bromação.
• Não necessita de catalisador para alceno e alcino, mas utiliza ÁCIDOS DE LEWIS (FeCl3, AlCl3, etc) como catalisador para CICLOALCANO;
• Em alceno, o produto formado é um di-haleto saturado;
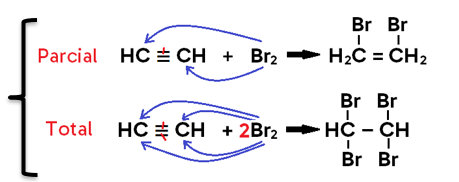
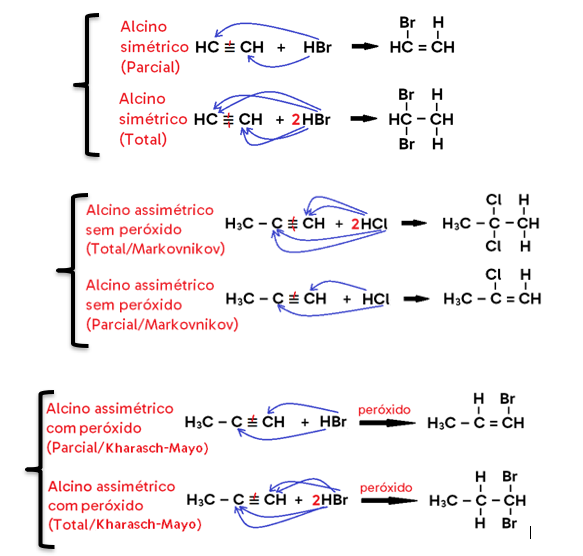
• Em alcino, o produto formado pode ser um di-haleto insaturado (caso se adicione 1 mol de X2, o que configura uma halogenação PARCIAL) ou um tetra-haleto saturado (caso se adicionem 2 mols de X2, o que configura uma halogenação TOTAL);
• Em cicloalcano, o produto formado é um di-haleto saturado;
Hidro-halogenação
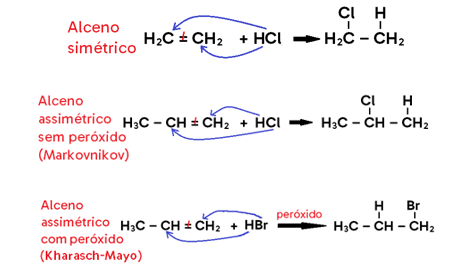
• Ocorre com ADIÇÃO DE HCl ou HBr (genericamente: HX) ao alceno, alcino ou cicloalcano;
• Não necessita de catalisador;
• Caso ocorra na AUSÊNCIA DE PERÓXIDO (peróxido de benzoíla, peróxido de hidrogênio, etc), utiliza-se a regra de MARKOVNIKOV;
OPA, Markovnikov?
Diz que quando a ligação dupla for assimétrica (isto é, o ligante de um lado da dupla é diferente do ligante do outro), o produto principal será aquele em que o H se adiciona ao CARBONO MAIS HIDROGENADO da dupla, enquanto o halogênio se liga ao menos hidrogenado. Como o produto secundário (em que o halogênio se liga ao carbono mais hidrogenado e o H se liga ao menos hidrogenado) é formado em quantidade muito menor, considera-se a formação apenas do produto principal.
• Caso ocorra na PRESENÇA DE PERÓXIDO, utiliza-se a regra de ANTI-MARKOVNIKOV ou regra de KARASH-MAYO;
OPA, Kharasch-Mayo?
Diz que quando a ligação dupla for assimétrica e a hidro-bromação ocorrer na presença de peróxido, o produto principal formado será aquele em que o H se adiciona ao CARBONO MENOS HIDROGENADO da dupla, enquanto o bromo se liga ao mais hidrogenado. Da mesma forma, o produto secundário (em que ocorre o inverso) é formado em quantidade muito menor, motivo pelo qual desconsideramos sua formação.
Importante: Kharasch-Mayo ocorre apenas para o HBr na presença de peróxido!
• Em alceno, o produto formado é um haleto saturado;
• Em alcino, o produto formado pode ser um haleto insaturado (caso se adicione 1 mol de HX, o que configura uma hidro-halogenação PARCIAL) ou um di-haleto saturado com 2 halogênios ligados ao mesmo carbono (caso se adicionem 2 mols de HX, o que configura uma hidro-halogenação TOTAL);
• Em cicloalcano, o produto formado é um haleto saturado.
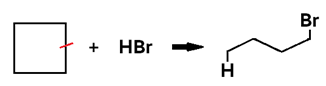
Obs.: Ciclopentano e ciclohexano não sofrem hidro-halogenação.
Hidratação
• Ocorre com ADIÇÃO DE ÁGUA (para fins didáticos, vamos representá-la por HOH) ao alceno, alcino ou cicloalcano;
• Só ocorre em MEIO ÁCIDO e sob AQUECIMENTO;
• Em compostos assimétricos, vale a regra de MARKVNIKOV;
• Em alceno, há formação de álcool;
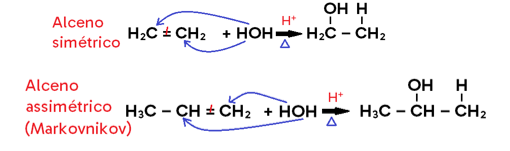
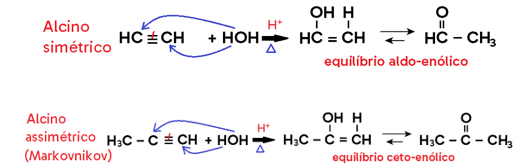
• Em alcino, há formação de enol, que entra em equilíbrio dinâmico (tautomeria) com aldeído ou cetona;
• Em cicloalcano, há formação de álcool.
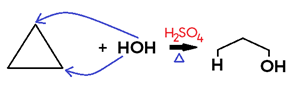
Obs.: Ciclopentano e ciclo-hexano não sofrem hidratação.