Introdução às Propriedades Físicas dos Compostos Moleculares
Fatores que alteram o Ponto de Ebulição dos compostos: Interações Intermoleculares
Fatores que alteram o Ponto de Ebulição dos compostos: Massa Molar
Solubilidade dos compostos moleculares
Ação do sabão
Ponto de ebulição (P.E)
Durante a mudança de estado físico (sólido, líquido e gasoso) são rompidas a ligações intermoleculares (ou interações intermoleculares), essas podendo ser do tipo:
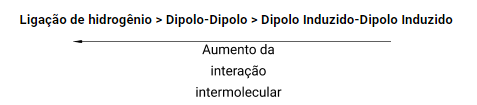
Quanto maior for a interação intermolecular maior será a energia necessária para rompê las. Logo, podemos pensar que os compostos que apresentarem uma interação intermolecular mais forte, possuem uma maior tendência em apresentar um maior ponto de ebulição. Porém existem outros fatores que também precisam ser levados em consideração.
Exemplo:
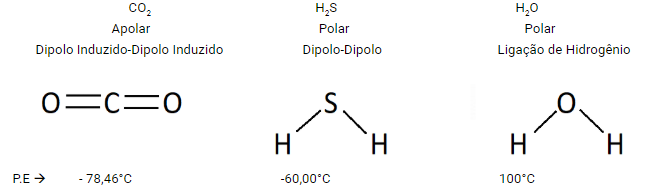
OBS: Ligação iônica, ligação covalente e ligação metálica, são ligações interatômicas, elas não são rompidam na mudança de estado físico.
Além da interação intermolecular, outro fator que deve ser levando em consideração, é a massa. Visto que, composto que apresentam uma maior massa molar, maior será o ponto de ebulição. Isso ocorre devido ao fato de, uma maior massa, aumenta a atração entre as moléculas.
Exemplo:
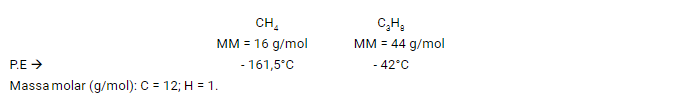
Podemos observar que, quem apresenta a maior massa, possui também uma maior ponto de ebulição.
Solubilidade
Quando a gente pensa em solubilidade, a gente tem que lembrar sempre da seguinte frase:
“Semelhante dissolve semelhante”
Essa frase quer dizer pra gente que, caso você tenha um composto polar, ao misturar o mesmo com um outro composto polar, estes irão ser solúveis. O mesmo vale para uma mistura entre dois compostos apolares. Porém se você pegar um polar e tentar misturar com um apolar, você irá observar duas fases na mistura. Ou seja, eles não são solúveis.
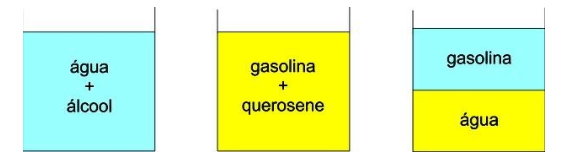
Tanto o álcool quanto a água, são polares. Logo, a mistura entre eles, forma uma única fase. Já a gasolina e o querosene, são ambos apolares. Ou seja, ao misturar os dois, temos também uma única fase. Mas ao pegarmos gasolina (apolar) com água (polar), temos então as duas fases bem aparente, isso ocorreu porque eles não são semelhantes, não apresentam a mesma polaridade.
Sabão
É constituído por um sal derivado de ácido carboxílico. E a sua estrutura apresenta uma longa sequência de carbonos.
Exemplo:
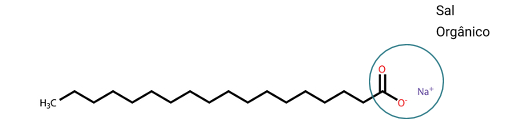
Como nós podemos observar, o sabão apresenta uma região polar, a do sal orgânico. E uma outra parte que é composta de carbonos e hidrogênios, sendo assim, essa região, apresenta uma característica apolar. E é por causa dessa região apolar e outra polar na molécula, que permite que ela atue como o sabão que a gente conhece.
Funcionamento
Sua parte apolar é hidrofóbica, ou seja, tem aversão à água, mas é lipofílica, isto é, interage com as moléculas da gordura (que também são apolares), “aprisionando-as” dentro de uma micela.
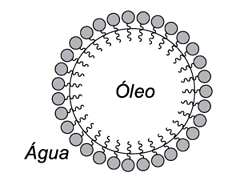
Depois disso, as extremidades polares das moléculas do sabão, que são hidrofílicas, ficam voltadas para fora, interagindo com a água. Fazendo assim, que o objeto seja limpo