Exercício 1: identificação de tipo de isomeria plana
Exercício 2: identificação de um isômero do hexanal
Exercício 3: fórmula estrutural plana de 2 isômeros do n-pentano
Exercício 4: identificando função orgânica, isomeria geométrica e interação intermolecular
Exercício 5: identificação de isômeros de posição
Exercício 6: identificação de isômeros e suas fórmulas estruturais
Exercício 7: relacionando estruturas e tipos de isomeria
Exercício 8: isomeria ótica
Isomeria
É o fenômeno quando dois ou mais compostos apresentam a mesma fórmula molecular porem com estruturas diferentes
De um modo amplo, a isomeria pode ser dividida em:
· Isomeria plana: Que depende da localização dos átomos na molécula e que pode ser explicada por fórmulas estruturais planas
· Isomeria espacial ou estereoisomeria (do grego stéreos, espacial): Que depende da orientação dos átomos no espaço e só pode ser explicada por fórmulas estruturais espaciais.
Isomeria plana
Isomeria de função (funcional)
Definição: Ocorre quando os isômeros pertencem a funções químicas diferentes.
Isomeria de cadeia
Definição: É aquela em que os isômeros têm cadeias, diferentes (aberta/fechada; ramificada/normal...).
Isomeria de posição
Definição: Ocorre quando os isômeros diferem pela posição de ramificações, de insaturações (duplas, triplas...) ou da função.
Isomeria de compensação (metameria)
Definição: Ocorre quando os isômeros diferem pela posição de um heteroátomo na cadeia carbônica.
Obs: Não confundir com isomeria de posição!
Tautomeria
Definição: É o caso particular de isomeria funcional em que os dois isômeros ficam em equilíbrio químico dinâmico.
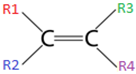
Isomeria espacial: geométrica
Cadeia aberta com ligação dupla:
Condições de ocorrência:
- Ter ligação dupla na cadeia;
- Possuir grupos radicais distintos no mesmo carbono da dupla, ou seja, R1 ≠ R2 e R3 ≠ R4
Isomeria espacial: óptica
Aqui nós iremos procurar o carbono quiral. Uma substância que possui carbono quiral apresentara atividade óptica.
Quando a substância possui atividade óptica:
Ela possui ISÔMEROS ÓPTICAMENTE ATIVOS: compostos de mesma fórmula molecular, porém com propriedades químicas distintas, pelo fato de terem conformações espaciais diferentes;
Ela pode desviar o plano da luz para a esquerda – neste caso, chamamo-la de isômero LEVÓGIRO – ou para a direita – isômero DEXTRÓGIRO;
Ela deve possuir, no mínimo, 1 CARBONO QUIRAL, ou seja, um carbono assimétrico, que faz com que a molécula toda seja assimétrica. É essa assimetria que causa o desvio do plano da luz;
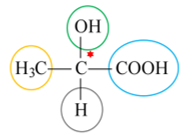
OPA, carbono quiral?
É o carbono que tem todos os grupos ligantes diferentes entre si, o que faz dele assimétrico.
Exemplo:
Ácido Láctico