Aminas
Amidas
Nitrilas
Nitrocompostos
Haleto orgânico
Haleto de ácido
Funções nitrogenadas
Vamos falar agora varias funções que apresentam o nitrogênio em seu grupo funcional. As duas que aparecem com mais frequência são as aminas e amidas. Estas duas funções orgânicas têm em comum um átomo de nitrogênio na cadeia carbônica, o que lhes confere – a depender do composto:
• Capacidade de fazer LIGAÇÕES DE HIDROGÊNIO entre si e com outras funções;
• SOLUBILIDADE EM ÁGUA, no caso de substâncias com cadeias carbônicas pequenas (até 4 ou 5 carbonos), devido às ligações de hidrogênio que fazem;
• POLARIDADE, visto que o átomo de nitrogênio é muito eletronegativo e tende a possuir dipolo negativo;
• PONTOS DE FUSÃO E EBULIÇÃO geralmente ALTOS, motivo pelo qual costumam ser sólidas ou líquidas (quando possuem cadeias carbônicas menores) à temperatura ambiente.
Veremos também as funções nitrogenadas conhecidas como nitrilas, isonitrilas e nitrocompostos.
I - Amina
As aminas são caracterizadas pela substituição de um ou mais hidrogênios da amônia (NH3) por um radical orgânico:
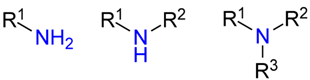
onde R é pelo menos um radical orgânico e/ou hidrogênios.
Classificação das aminas
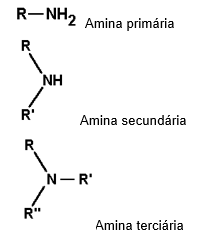
onde os R’s são radicais orgânicos.
Nomenclatura
Radical orgânico + AMINA
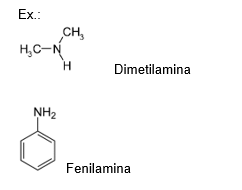
II - Amida
As amidas são caracterizadas pela presença do grupo funcional:

Classificação das amidas
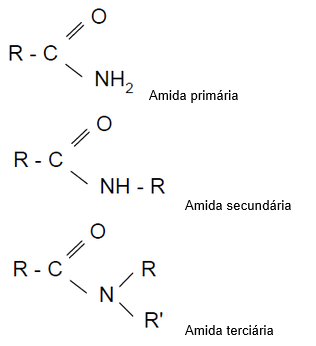
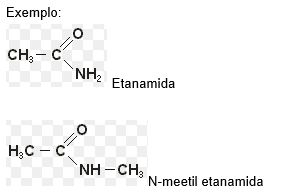
Nomenclatura
Nome do hidrocarboneto + AMIDA
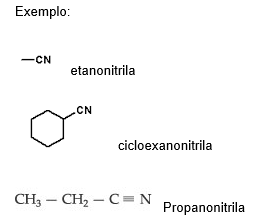
III – Nitrila
As nitrilas são caracterizadas pelo radical:

Nomenclatura
Nome do hidrocarboneto + NITRILA
IV – Isonitrila
As isonitrilas são caracterizadas pela presença do radical:

Nomenclatura
Nome do radical + CARBILAMINA
Exemplo:
CH3 – NC metilcarbilamina
CH3 – CH2 – CH2 – NC propilcarbilamina
V – Nitrocomposto
Os nitrocompostos são caracterizados pela presença do grupo funcional:

Nomenclatura:
NITRO + Nome do hidricarboneto
Exemplo:
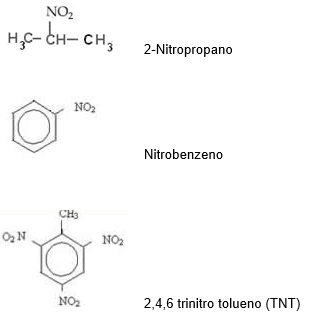
Haletos orgânicos
Os haletos orgânicos são genericamente representados por:
R – X , onde R é um radical orgânico e X é halogênio (F, Cl, Br, I).
Exemplo:
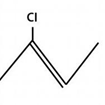
Os haletos orgânicos possuem algumas propriedades peculiares, são elas:
-São tóxicos
-Possuem odor agradável
-Com 1 ou 2 carbonos são gasosos nas CNTP
-São muitos reativos (reagem com facilidade)
-Geralmente são apolares ou levemente polares
Nomenclatura:
Nome do halogênio + nome do hidrocarboneto
Exemplos:
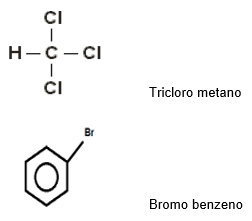
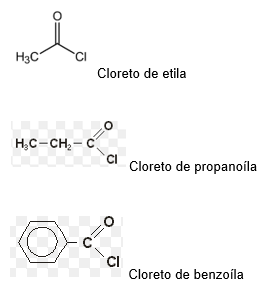
Haletos de acila
Os haletos de acila são derivados da substituição da hidroxila de um ácido carboxílico por um halogênio.

Assim como os haletos orgânicos, os haletos de acila possuem algumas propriedades peculiares, são elas:
-Possuem ponto de fusão e ebulição altos e quanto maior a massa molar do haleto, maiores são esses pontos.
Quando possuem cadeias carbônicas pequenas:
-São tóxicos
-Possuem odor forte
-São muitos reativos (reagem com facilidade)
Nomenclatura:
Nome do halogênio+ETO de nome do hidrocarboneto+ILA