Um breve histórico
Famílias e períodos
Bloco “s”
Bloco “p”
Bloco “d”
Bloco “f”
Classificação segundo as características
A Tabela Periódica dos elementos químicos, está organizada em função dos números atômicos dos elementos químicos, suas propriedades e características.
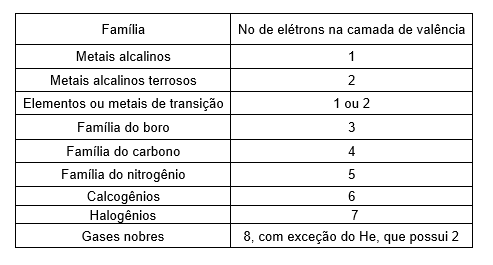
Os elementos na Tabela Periódica estão em ordem crescente de seus números atômicos e podem ser classificados como:
Metais: Na temperatura de 25 °C e pressão de 1 atm eles são sólidos, com exceção do mercúrio (Hg), que é líquido. São bons condutores de calor e eletricidade e possuem brilho, maleabilidade (capacidade de ser moldado) e ductilidade (capacidade de formar fios).
Não metais ou Ametais: Apresentam características opostas às dos metais, pois não são bons condutores de calor e eletricidade e não possuem brilho, com exceção do iodo.
Gases Nobres: São gasosos na temperatura ambiente e encontrados na natureza em sua forma isolada por serem estáveis; a nível médio não formam compostos com outros elementos espontaneamente.
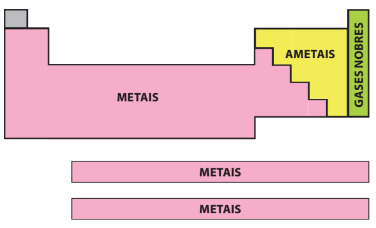
Tabela periódica de classificação dos elementos
Existem outras classificações para os elementos, eles são divididos em períodos e famílias.
Períodos → Linhas horizontais da tabela, no total são sete. Em termos de distribuição eletrônica, o período refere-se às quantidades de camadas de um átomo eletricamente neutro (estado fundamental) possui.
Exemplo:
Be – Situado no segundo periodo, possui duas camadas, K e L.
Cs – Situado no sexto periodo, possui seis camadas, K, L, M, N, O e P.
Grupo ou famílias → Linhas verticais da tabela, no total são dezoito. Atualmente os grupos são identificados pelos números de 1 a 18, contudo, há uma maneira mais antiga e ainda usual: divisão em sub-grupos ou famílias. Elementos representativos e de transição
Nos elementos representativos, ou seja, os grupos 1, 2 e de 13 a 18, o elétron mais energético está no subnível s ou p. Já os elementos de transição podem ser divididos em dois grupos distintos: os de transição externa, estando o seu elétron de maior energia no subnível d (se encontram no centro da tabela periódica), e os de transição interna, com o seu elétron de maior energia no subnível f (Se encontram nas duas linhas, que geralmente, estão no inferior de cada tabela).
Nomenclatura das famílias
Grupo 1 (1A) → Metais alcalinos
Grupo 2 (2A) →Metais alcalinos terrosos
Grupos 3 ao 12 (3B ao 2B)→ Elementos ou metais de transição
Grupo 13 (3A) →Família do boro
Grupo 14 (4A) → Família do carbono
Grupo 15 (5A) →Família do nitrogênio
Grupo 16 (6A) →Calcogênios
Grupo 17 (7A) →Halogênios
Grupo 18 ou 0 (8A) →Gases nobres
Atenção!
Vale lembrar que o Hidrogênio não pertence a família 1, mesmo estando na primeira coluna.
O hidrogênio não possui família.
Configuração eletrônica dos elementos na tabela periódica