Reação entre um óxido e um ácido
Reação entre um ácido e uma base
Fórmulas dos compostos iônicos
Decomposição do peróxido de hidrogênio
Nomenclatura de bases e sais
Óxidos ácidos e óxidos básicos
BASES
Segundo Arrhenius, são substâncias inorgânicas que quando colocadas em presença de água sofrem dissociação iônica, liberando como único ânion a hidroxila (OH-).
XOH → X+ + OH−
Classificação
Quanto ao número de hidroxilas
Em função do número de hidroxilas(OH-) liberadas quando sofrem dissociação iônica, uma base pode ser classificada como:
Monobase - libera uma ânion OH-
Ex.: NaOH → Na+ + OH−
Dibase - libera dois ânions OH-
Ex.: Mg(OH)2 → Mg+2 + 2OH−
Tribase - libera três ânions OH-
Ex.: Al(OH)3 → Al+3 + OH−
Tetrabase - libera quatro ânions OH-
Ex.: Pb(OH)4 → Pb+4 + OH−
Quanto à solubilidade em água
Solubilidade de uma base é a propriedade que indica o quanto uma base é capaz de se dissolver em água, ela pode ser classificada como:
Solúvel - Possui grande capacidade de se dissolver em água. São as bases formadas por elementos da família IA e NH^{4+}4+.
Parcialmente solúvel - Pouco capaz de se dissolver em água. São as bases formadas por elementos da família IIA.
Insolúvel - Não é capaz de se dissolver em água. São as bases formadas pelos demais elementos.
Quanto a força
A força de uma base é dada pela sua capacidade de liberar OH- (sofrer dissociação iônica) quando colocadas em presença de água, quanto maior a quantidade de OH- liberados, maior será a força da base.
Forte - São as bases formadas por elementos do grupo 1 e 2
Fraca - São as bases formadas pelos demais elementos.
IMPORTANTE: As bases formadas por Mg(OH)2 e Be(OH)2, que são elementos do grupo 2, são consideradas insolúveis e fracas.
Nomenclatura
Elementos com NOX fixo:
Família IA, IIA, Ag+1, Zn+2, Cd+2, Al+3 e NH4+.
Hidróxido de nome do elemento
Ex.:
NaOH - Hidróxido de sódio
Mg(OH)2 - Hidróxido de magnésio
Al(OH)3 - Hidróxido de alumínio
Elementos com NOX variável:
Fe, Co, Ni = +2 ou +3
Cu, Hg = +1 ou +2
Au = +1 ou +3
Pb, Pt, Sn = +2 ou +4
Hidróxido de nome do elemento _+ NOX(em romanos)
ou
Hidróxido de nome do elemento + sufixo OSO (menor NOX) / sufixo ICO (maior NOX)
Ex.:
CuOH - Cu com nox +1 - Hidróxido de cobre I ou Hidróxido cuproso
Cu(OH)2 - Cu com nox +2 - Hidróxido de cobre II ou Hidróxido cúprico
Pb(OH)2 - Pb com nox +2 - Hidróxido de chumbo II ou Hidróxido plumboso
Pb(OH)4 - Pb com nox +4 - Hidróxido de chumbo IV ou Hidróxido plúmbico
Formulação das bases
Quando precisamos montar a fórmula de uma base a partir de seu nome, basta unir o cátion desejado ao ânion OH- .
Note que a carga total do OH- deverá anular a carga total do cátion.
Ex.:
Hidróxido de cálcio
Ca+2 e OH−
logo para anular a carga +2 do cálcio precisamos de 2 ânions OH-
Ca+2 + 2OH- → Ca(OH)2
Hidróxido férrico
Fe+3 e OH-
logo para anular a carga +3 do ferro precisamos de 3 ânions OH-
Fe+3 + 3OH- → Fe(OH)3
ÁCIDOS
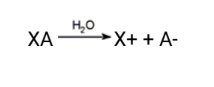
Segundo Arrhenius, são substâncias inorgânicas que quando colocadas em presença de água sofrem ionização, liberando como único cátion o H+.
HA → H+ + A−
HAO → H+ + AO−
Classificação
Quanto a presença de oxigênio
Inicialmente os ácidos podem ser separados em duas categorias para serem estudadas, os Oxiácidos (que possuem oxigênio em sua molécula) e Hidrácidos (que NÃO possuem oxigênio em sua molécula).
Ex.:
Hidrácidos = HCl, HF, HCN.
Oxiácidos = H2SO4, HClO, H3PO4
Quanto ao número de H+
Em função do número de íons H+ liberados quando sofrem ionização, uma ácido pode ser classificada como:
Monoácido - libera uma cátion H+
Ex.: HCl → H+ + Cl−
Diácido - libera dois cátions H+
Ex.: H2SO4 → 2H+ + SO4−2
Triácido - libera três cátions H+
Ex.: H3PO4 → 3H+ + PO4-3
Tetrácido - libera quatro cátions H+
Ex.: H4SiO4 → 4H+ + SiO4-
ATENÇÃO!
Os ácidos formados por P, As e Sb com fórmulas:
H3XO3 - são diácidos
H2XO3 - são monoácidos
Quanto a força

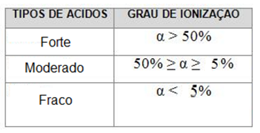
A força dos ácidos é dada pelo seu grau de ionização(α). O grau de ionização é relação entre o número de moléculas dissolvidas sobre o número de moléculas que produziram íons.
Os Hidrácidos mais comuns são classificados como:
Forte: HCl, HBr e HI
Moderado: HF
Fraco: os demais
Os Oxiácidos mais comuns são classificados da seguinte forma:
X = números de oxigênios – números de hidrogênios
Forte: x > 1
Moderado: x = 1
Fraco: x < 1
Nomenclatura para Hidrácidos
Ácido nome do elemento + ídrico
Ex.: HCl - Ácido clorídrico
HI - Ácido Iodídrico
HCN - Ácido cianídrico
Nomenclatura para Oxiácidos
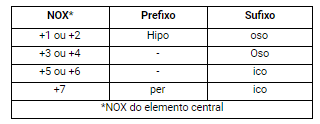
Cuidado!
C+4, Si+4 e B+3 = ICO

Ex.:
H2SO4 - S+6 - Ácido sulfúrico
H3PO4 - P+5 - Ácido fosfórico
H2CO3 - C+4 - Ácido carbônico
ÓXIDOS
Óxidos são compostos binários (2 elementos) nos quais o oxigênio é o elemento mais eletronegativo.
Por exemplo: H2O, CO2 , Fe2O3 , SO2 , P2O5 etc.
Existem compostos binários com oxigênio onde ele não é o mais eletronegativo, então não pode ser considerado um óxido, são eles:
OF2 e O2F2 que são considerados sais, pois nesse caso o flúor é o elemento mais eletronegativo, saindo assim da definição de óxidos.
Classificação dos óxidos
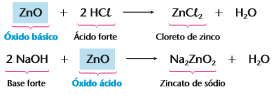
Óxidos básicos: São óxidos que reagem com a água, produzindo uma base, ou reagem com um ácido, produzindo sal e água, geralmente óxidos onde o metal tem nox +1,+2 ou +3.
Exemplo:
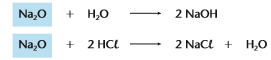
Nomenclatura dos óxidos básicos
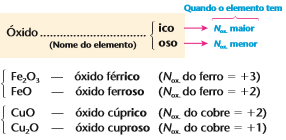
Quando o elemento forma apenas um óxido, nomeamos com a palavra óxido + o nome do elemento, exemplo:
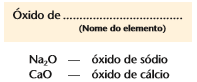
Caso o elemento forme mais de um óxido (nox variável), acrescentamos o sufixo ico(maior nox) ou oso (menor nox) ao nome do metal em questão, exemplo:
Podemos representar também com nome escrito com algarismos romanos:
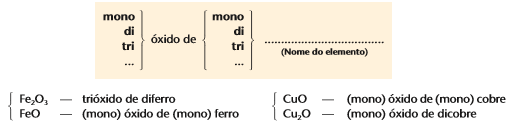
Outra forma de nomear os óxidos é usando algarismos romanos, exemplo:
Fe2O3: Óxido de ferro III
FeO: Óxido de ferro II
CuO: Óxido de cobre II
Cu2O: Óxido de cobre I
Óxidos ácidos ou anidridos: São óxidos que reagem com a água, produzindo um ácido, ou reagem com uma base, produzindo sal e água, onde o nox do metal (nox possíveis: +5, +6 ou + 7) ou com qualquer ametal (excluindo os ametais dos óxidos neutros).
Exemplo:
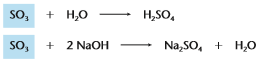
O nome anidrido vem do fato desse tipo de óxido ter a capacidade absorver água e forma seu respectivo ácido.
Exemplo: SO3 + H2O → H2SO4
Anidrido sulfúrico, óxido de enxofre IV ou trióxido de enxofre + água → Ácido sulfúrico
Nomenclatura dos óxidos ácidos
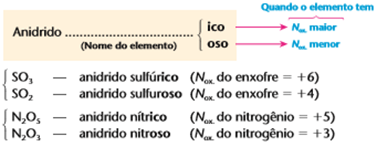
Obs1 : Quando o elemento possuir 4 anidridos diferentes, ou seja, 4 nox diferentes
Nox+1: Anidrido Hipo…oso
Nox +3: Anidrido…oso
Nox +5: Anidrido…ico
Nox +7: Anidrido Per…ico
Exemplos:
Cl2O: Anidrido Hipocloroso
Cl2O3: Anidrido cloroso
Cl2O5: Anidrido clórico
Cl2O7: Anidrido Perclórico
Obs2: Quando o óxido tem apenas um um anidrido, usa-se a terminação ico.
Exemplo:
CO2 — anidrido carbônico
B2O3 — anidrido bórico
Obs3: Podemos usar a terminação já citada utilizando números romanos ou os prefixos mono,di,tri…
Obs4: Alguns anidridos podem reagir com quantidades crescentes de água (hidratação crescente), produzindo ácidos diferentes. É o caso do anidrido fosfórico (P2O5 ).
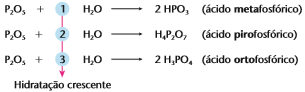
Óxidos anfóteros: Podem se comportar ora como óxido básico, ora como óxido ácido, onde o metal pode ter nox +3 ou +4(exceção do Zn,Pb,Sn) ou o oxigênio estar ligado a um ametal(excluindo os ametais dos óxidos neutros).
Os óxidos anfóteros são, em geral, sólidos, iônicos, insolúveis na água. Os mais vistos em provas ou vestibulares são:
ZnO; Al2O3; SnO ; SnO2 ; PbO ; PbO2; As2O3; As2O5; Sb2O3 e Sb2O5.
Nomenclatura dos óxidos anfóteros
A nomenclatura é idêntica à dos óxidos básicos:
ZnO — óxido de zinco
SnO2 — óxido estânico ou óxido de estanho IV, ou dióxido de estanho
SnO — óxido estanoso ou óxido de estanho II, ou (mono) óxido de estanho
Óxidos neutros: São óxidos que não reagem com água, nem com ácidos nem com bases. Existem muito poucos óxidos com essa classificação, os exemplos mais comuns são:
CO - monóxido de carbono
N2O-óxido nitroso
NO - óxido nítrico
Obs: Muitos autores consideram a água(H2O) um óxido neutro.
Óxidos duplos, mistos ou salinos: São óxidos que se comportam como se fossem formados por dois outros óxidos, do mesmo elemento químico, onde seu nox equivale a 8/3.
Exemplo:
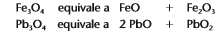
Para dar nome aos óxidos duplos, mistos ou salinos, devemos seguir esta regra:
Tetraóxido + de + nome do elemento + tri = nome do elemento ligado ao Oxigênio
Exemplos:
Fe3O4 = Tetraóxido de triferro
Pb3O4 = Tetraóxido de trichumbo
Mn3O4 = Tetraóxido de trimanganês
Peróxidos: São óxidos que reagem com a água ou com ácidos diluídos, produzindo água oxigenada (H2O2).
Exemplo:
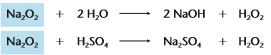
A nomenclatura é feita com a própria palavra peróxido. Por exemplo:
Na2O2 - Peróxido de sódio
E os peróxidos mais comuns são os de hidrogênio, e utilizando metais da família 1A e 2A.
Superóxidos: São óxidos onde o nox do oxigênio é -½ (ao invés do comum -2), além de serem formados por esses compostos são formados por metais alcalinos e metais alcalinos terrosos.
A nomenclatura dos superóxidos baseia-se na seguinte regra:
Superóxido + de + nome do elemento que acompanha o oxigênio
Exemplo:
K2O4: Superóxido de potássio
Na2O4: Superóxido de sódio
CaO4: Superóxido de cálcio
MgO4:Superóxido de magnésio
SrO4: Superóxido de estrôncio
SAIS
Sal é toda substância, que em solução aquosa, libera pelo menos um cátion diferente de H+ e um ânion diferente de OH-
Classificação
Sal neutro:
Não apresenta hidrogênio(H+) ionizável e nem hidroxila(OH−) em sua composição.
Ex.: NaCl, BaSO4 e CaCO3
Sal ácido ou hidrogenossal:
Apresenta H ionizável em sua composição.
Ex.: Ba(OH)Cl, Ca(OH)Br
Sal hidratado:
Possui moléculas de H2O associadas ao seu retículo cristalino.
Ex.: CuSO4 . 5H2O
CaSO4 . 2H2O
Sal duplo:
Sal que apresenta dois cátions diferentes(exceto o H ionizável), ou dois ânions diferentes(exceto OH^-OH−).
Ex.: NaLiSO4, AlSO4I
Reação de neutralização
Um sal pode ser obtido através de uma reação chamada reação de neutralização, que consiste em:
ácido + base→ sal + água
Ex.: HCl+ NaOH → NaCl + H2O
Essa reação pode ocorrer de forma total ou parcialmente.