Questão 1 - Óxidos
Questão 2 - Tabela Periódica e suas propriedades
Questão 3 - Fórmula Molecular de um sal
Questão 4 - Aplicações de compostos inorgânicos
Questão 5 - Óxidos ácidos
Questão 6 - Óxidos
ÓXIDOS
Óxidos são compostos binários (2 elementos) nos quais o oxigênio é o elemento mais eletronegativo.
Por exemplo: H2O, CO2 , Fe2O3 , SO2 , P2O5 etc.
Existem compostos binários com oxigênio onde ele não é o mais eletronegativo, então não pode ser considerado um óxido, são eles:
OF2 e O2F2 que são considerados sais, pois nesse caso o flúor é o elemento mais eletronegativo, saindo assim da definição de óxidos.
BASES
Segundo Arrhenius, são substâncias inorgânicas que quando colocadas em presença de água sofrem dissociação iônica, liberando como único ânion a hidroxila (OH-).
XOH → X+ + OH−
ÁCIDOS
Segundo Arrhenius, são substâncias inorgânicas que quando colocadas em presença de água sofrem ionização, liberando como único cátion o H+.
HA → H+ + A−
HAO → H+ + AO−
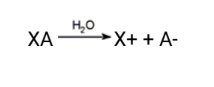
SAIS
Sal é toda substância, que em solução aquosa, libera pelo menos um cátion diferente de H+ e um ânion diferente de OH-