Cloreto de sódio
Carbonato de sódio
Função dos compostos inorgânicos
Hipoclorito de sódio
Reação entre carbonato de cálcio e ácido clorídrico
Reação entre ácido sulfúrico e hidróxido de sódio
Como tornar o meio básico
Tungstênio
Definição
Sal é toda substância, que em solução aquosa, libera pelo menos um cátion diferente de H+ e um ânion diferente de OH-
Classificação
Sal neutro:
Não apresenta hidrogênio(H+) ionizável e nem hidroxila(OH−) em sua composição.
Ex.: NaCl, BaSO4 e CaCO3
Sal ácido ou hidrogenossal:
Apresenta H ionizável em sua composição.
Ex.: Ba(OH)Cl, Ca(OH)Br
Sal hidratado:
Possui moléculas de H2O associadas ao seu retículo cristalino.
Ex.: CuSO4 . 5H2O
CaSO4 . 2H2O
Sal duplo:
Sal que apresenta dois cátions diferentes(exceto o H ionizável), ou dois ânions diferentes(exceto OH^-OH−).
Ex.: NaLiSO4, AlSO4I
Reação de neutralização
Um sal pode ser obtido através de uma reação chamada reação de neutralização, que consiste em:
ácido + base→ sal + água
Ex.: HCl+ NaOH → NaCl + H2O
Essa reação pode ocorrer de forma total ou parcialmente.
Neutralização total
Ocorre quando um ácido e uma base reagem e a quantidade de H+ do ácido é estequiometricamente igual a quantidade de OH^-OH− da base.
Ex.: ácido + base→ sal + água
H2SO4 + Mg(OH)2 → MgSO4 + 2H2O
óxido básico + ácido → sal + água
CaO + 2HBr → CaBr2 + H2O
óxido ácido + base → sal + água
CO2 + 2NaOH → Na2CO3 + H2O
óxido ácido + óxido básico → sal
CO2 + CaO → CaCO3
óxido anfótero + ácido → sal + água
ZnO + H2SO4 → ZnSO4 + H2O
óxido anfótero + base → sal + água
Al2O3 + 2KOH → 2KAlO2 + H2O
Neutralização parcial
Ocorre quando um ácido e uma base reagem e as suas quantidade de H+ e OH− são estequiometricamente diferentes. Produzindo um sal ácido ou um sal básico
Ex.: H2SO4 + NaOH → NaHSO4 + H2O
HNO3 + Mg(OH)2 → MgOHNO3 + H2O
Nomenclatura
A nomenclatura de um sal será dada a partir do nome do ânion derivado do seu ácido formador.
Para derivados de hidrácidos:

Ex.: NaCl → Cloreto de sódio
KBr → Brometo de potássio
Para derivado de oxiácidos:

Ex.: BaSO4 → Sulfato de bário
NaClO → Hipoclorito de sódio
CaCO3 → Carbonato de cálcio
Formulação
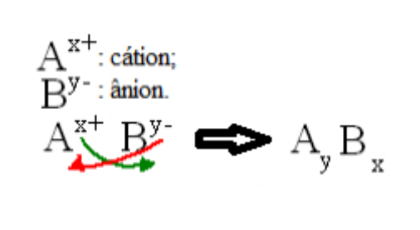
Ex.: Nitrato de cálcio
Ca+2 e NO3 = Ca3(NO3)2
Carbonato de magnésio
Mg+2 e CO3−2 = MgCO3
Sulfato de sódio
Na+ e SO4+2 = Na2SO4
Cloreto de potássio
K+ e Cl− = KCl