Camadas e subníveis
Diagrama das diagonais
Aprendendo a fazer a distribuição eletrônica
Distribuição de íons
Distribuição anômala
Distribuicao compacta
Distribuição eletrônica
Para facilitar a distribuição eletrônica, um diagrama prático de distribuição eletrônica foi proposto. Nele, os elétrons são distribuídos em ordem crescente de energia em níveis e subníveis na eletrosfera do átomo. Veja o Diagrama de Pauling de subníveis de energia, na figura abaixo, e perceba a ordem de preenchimento expressa nas setas vermelhas.
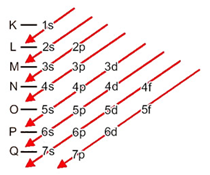
Neste ponto, é importante notar que os elétrons que existem hoje, com exceção dos descobertos em 2016, se distribuem em até 7 níveis de energia e cada nível contém um determinado número de subníveis. Além disso, todo átomo tem um certo número de elétrons* que devem ser preenchidos seguindo o Diagrama de Pauling.
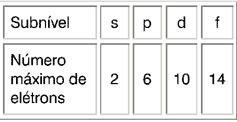
O subnível s comporta o máximo de 2 elétrons; o p, 6; o d, 10 e o f, 14.
Veja o preenchimento de um átomo de Bário que possui 56 elétrons como exemplo:
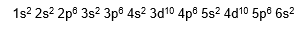
O preenchemento da eletrosfera pelos elétrons em subníveis obedece à ordem crescente de energia definida pelo diagrama de Pauling. Sendo assim, no exemplo acima, o subnível mais energético é o 6s2.
O preenchemento da eletrosfera pelos elétrons em subníveis obedece à ordem crescente de energia definida pelo diagrama de Pauling. Sendo assim, no exemplo acima, o subnível mais energético é o 6s2.
Atenção!
O elétron de diferenciador é o ultimo elétron a entrar no subnivel mais energetico. No Bário o elétron diferenciador é o segundo elétron do subnível 6s2.
*Para saber o número de elétrons a preencher em um átomo neutro lembre-se que o número de prótons é igual ao número de elétrons em um átomo neutro. Portanto, o número atômico indicará o número de elétrons. No caso de íons, deve-se adicionar ou remover elétrons à quantidade de elétrons no átomo neutro, mas todo muito cuidado, alguns podem gerar pequenas confusões.
Íons podem seguir a seguinte regra de distribuição: faz-se o preenchimento do átomo em seu estado neutro e, depois, retira(m)-se o(s) elétron(s) da camada de valência (a mais externa). No caso de ânions, adicionam-se os elétrons nas camadas seguintes.

Distribuição por camadas e por subníveis
Camadas serão representadas por letras ou números (de 1 a 7 ou de K a Q) e suportam um número definido de elétrons (representadas abaixo):
Camada 1 ou K = 2;
Camada 2 ou L = 8;
Camada 3 ou M = 18;
Camada 4 ou N = 32;
Camada 5 ou O = 32;
Camada 6 ou P = 18;
Camada 7 ou Q = 8.
Perceba a diferença entre os tipos de preenchimento pelo exemplo do enxofre (S). Em uma das distribuições, mostram-se os subníveis, enquanto a outra mostra apenas as camadas preenchidas.
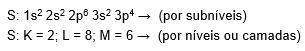
A camada de valência é o nível mais afastado do núcleo e que corresponde sempre ao maior valor em suas camadas e não necessariamente é a última da sequência, mas sim aquela que se encontra na camada mais externa, no caso do Enxofre(S) acima, é o 3s4, portanto, camada 3 ou M e no Fe2+ é o 4s2 portanto, camada 4 ou N.