Mistura de soluções com reações químicas
Exercício 1 - Parte 1
Exercício 1 - Parte 2
Titulação
Exercício 2 - Parte 1
Exercício 2 - Parte 2
Exercício 2 - Parte 3
Mistura de soluções com reação química
Os casos mais comuns ocorrem quando juntamos um ácido uma base, ou um oxidante e um redutor; ou soluções de dois sais que reagem entre si. Quando há reação química, podem ocorrer duas situações:
1ª. Os dois solutos estão em quantidades exatas para reagir (proporção estequiométrica);
2ª. Caso contrário, sobrará um excesso do primeiro ou do segundo soluto. A seguir exemplificamos esses dois casos.
1º exemplo:
Quando os solutos estão em proporção estequiométrica:
Juntando-se 300mL de HCl 0,4 molar com 200mL de NaOH 0,6 molar, pergunta-se quais serão as molaridades da solução FINAL com respeito:
a) ao ácido;
b) à base;
c) ao sal formado.
Resolução: Neste exemplo, fala-se de uma mistura de uma solução de HCl com outra, de NaOH. Esses dois solutos reagem de acordo com a equação:
HCl + NaOH --> NaCl + H2O
Pode haver excesso de HCl ou de NaOH, o que somente poderemos determinar por meio do cálculo estequiométrico. O cálculo estequiométrico fica mais fácil se for efetuado com o auxílio das quantidades de mols dos reagentes e dos produtos da reação. Ora, a quantidade de mols (n) de cada soluto pode ser calculada de duas maneiras:
1ª) n = m/MM , em que: m é a massa (gramas), e MM , a massa molar (g/mol)
2ª) n = M.V ,em que :M é a molaridade da solução(mol/L),e V ,o seu volume (L).
Como na questão foi dada a molaridade das soluções, calculamos da seguinte forma:
Para o ácido: n = M.V -> n = 0,4 mol/L * 0,3 L -> n = 0,12 mol de HCl
Para a base: n = M.V -> n = 0,6 mol/L * 0,2 L -> n = 0,12 mol de NaOH
Como podemos observar as proporções ácido-base da reação (1:1) tendo 0,12 mol de cada chegamos a conclusão que todo o ácido e toda a base reagiram por completo sem excessos. E se a base e o ácido reagiram por completo, eles se transforam todo no sal (NaCl) suas concentrações finais são iguais a zero. Quanto ao sal, podemos dizer que:
Já que a proporção da reação é de 1:1:1, formam-se 0,12mol desse sal, dissolvido em água, na solução final, cujo volume é: 300 mL + 200 mL = 500 mL. Portanto, a molaridade do NaCl será:
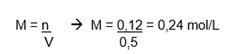
2º exemplo:
Quando os solutos não estão em proporção estequiométrica:
Juntando-se 300mL de HCl 0,4 molar com 200mL de NaOH 0,8 molar, pergunta-se quais serão as molaridades da solução FINAL com respeito:
a) ao ácido;
b) à base;
c) ao sal formado.
Resolução: Seguindo o mesmo raciocínio que fizemos para resolver o exemplo anterior, calculamos as quantidades, em mols, dos solutos iniciais:
Para o ácido: n = M.V -> n = 0,4 mol/L * 0,3 L -> n = 0,12 mol de HCl
Para a base: n = M.V -> n = 0,8 mol/L * 0,2 L -> n = 0,16 mol de NaOH
Perceba que a proporção de numero de mol dessa vez não está de 1:1, temos um excesso de base. Todo o ácido irá ser consumido, porém 0,4 mol da base irão sobrar no fim da reação (0,16 NaOH - 0,12 HCl = 0,4 NaOH).

Titulação
Quando se precisa saber a concentração em mol/L de alguma solução, costuma-se usar uma técnica de análise volumétrica chamada titulação, ou, titulação ácido-base. Esse método é feito colocando-se para reagir uma solução a qual se sabe a concentração, que é denominada de titulante, com a solução a qual não se sabe a concentração, que é denominada de titulado. Uma dessas soluções é uma base, enquanto a outra é um ácido, logo elas reagem formando sal e água. O pH costuma ficar neutro ou próximo disso, o que equivale a um pH igual a 7. É preciso saber equacionar esse tipo de reação para os cálculos usados na titulação, conforme será mostrado mais adiante.
Com a adição de um indicador ácido-base(fenoftaleína, azul de bromotimol, alaranjado de metila…), observa-se quando a reação se completa, atingindo o ponto de viragem. É possível saber quando isso ocorre e parar a reação, porque a cor da solução sofre uma mudança brusca na presença de um indicador ácido-base, em virtude da variada do pH. No entanto, embora o ponto de equivalência indique o término da titulação, nem sempre os volumes das soluções que são utilizadas resultam em uma solução final neutra, com pH igual a 7.
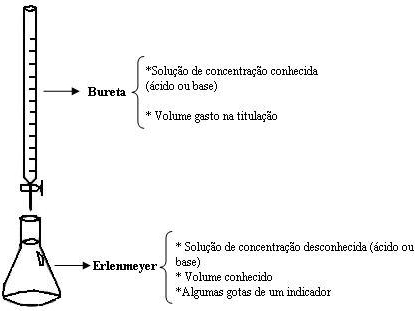
Veja o passo a passo de como costuma ser feita uma titulação ácido-base em laboratório:
• Com o auxílio de uma pipeta, transfere-se um volume conhecido do titulado para um erlenmeyer.
• Adicionam-se poucas gotas de algum indicador ácido-base, como a fenolftaleína, ao titulado;
• Completa-se o volume de uma bureta com a solução titulante.
• Inicia-se a reação abrindo vagarosamente a torneira da bureta para que, gota a gota, o titulante caia sobre o titulado. Enquanto uma das mãos permanece sobre a torneira (para que, se for preciso, ela seja fechada imediatamente), a outra mão fica agitando o erlenmeyer para que a reação ocorra em toda a extensão da solução que está sendo titulada.
• Quando a cor do titulado muda bruscamente, fecha-se a torneira da bureta, pois a reação se completou.
• Por exemplo, se o indicador usado foi a fenolftaleína e o titulado era inicialmente uma solução de ácido clorídrico (HCl), a solução com o indicador estava incolor. Mas, no ponto de viragem, a solução passa para a cor rosa.
Agora, basta ler o volume de titulante que foi necessário para neutralizar o titulado, equacionar a reação que ocorreu e, com os outros dados em mãos, fazer as contas para descobrir a concentração do titulado.
Esquema de uma titulação:
Exemplo: 20 mL de uma solução de NaOH de concentração desconhecida foi titulada com uma solução de HCl de concentração igual a 0,5 mol/L. Sabendo que 40 mL de ácido foi necessária para que a titulação seja completa, qual a concentração da solução básica?
Xácido . Mácido . Vácido = Xbase . Mbase . Vbase
1 . 40 mL . 0,5 mol/L = 1 . Mbase . 20 mL
Mbase = 1 mol/L de base