Diluição
Mistura de soluções com o mesmo soluto
Mistura de soluções com o mesmo soluto diluição
Mistura de soluções de solutos diferentes
Mistura de soluções de solutos que reagem e cálculo de impurezas
Mistura de soluções de solutos que reagem
Misturas de soluções de uma mesmo soluto
Vamos imaginar duas soluções (A e B) de cloreto de sódio (NaCl), como ilustrado abaixo. Na solução final (A + B), a massa do soluto é igual à soma das massas dos solutos em A e B.
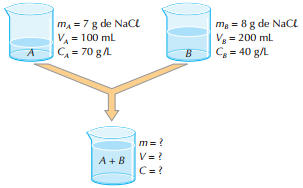
Portanto: m = 7 + 8 ⇒ m = 15 g de NaCl
O volume da solução também é igual à soma dos volumes das soluções A e B. Portanto:
V = 100 + 200 ⇒ V = 300 mL de solução Com esses valores e lembrando a definição de concentração, obtemos, para a solução final (A + B):
300 mL de solução ---------- 15 g de NaCl
1.000 mL de solução -------- C
Cfinal = 50 g/L
ou
C = m/V = 15 g/0,3L = 50 g/L
Obs: É interessante notar que a concentração final (50 g/L) terá sempre um valor compreendido entre as concentrações iniciais (70 g/L > 50 g/L > 40 g/L).
podemos generalizar esse tipo de problema, da seguinte maneira:
• massa do soluto na solução A: ma = Ca.Va
• massa do soluto na solução B: mb = Cb.Vb
• massa do soluto na solução final: m = CV
Como as massas dos solutos se somam (m = ma + mb ), temos:
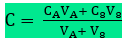
Exemplo:
200 mL de uma solução a 0,2 mol.L-1 de KBr é misturada a 100mL de uma solução de mesmo soluto com concentração igual a 0,4 mol.L-1. Qual a concentração da mistura obtida?
Solução 1
V = 200 mL
M = 0,2 mol.L-1
Solução 2
V = 100 mL
M = 0,4 mol.L-1
Solução final
Vf = V1 + V2
Vf = 200 + 100
Vf = 300 mL
M1 . V1 + M2 . V2 = Mf . Vf
0,2 . 200 + 0,4 . 100 = Mf . 300
Mf = 0,27 mol.L-1 de KBr.
Mistura de duas soluções de solutos diferentes que não reagem entre si
Supondo que tenhamos soluções A e B, a primeira, uma solução de NaCl, e a segunda, de KCl.
O volume da solução final (A + B) será: V = VA + VB. Nela reaparecerão inalterados os solutos NaCl e KCl, pois eles não reagem entre si e como os solutos não reagem, cada soluto vai ser tratado de forma independente, logo, podemos aplicar as fórmulas da diluição nesse tipo de mistura.
para o NaCl: VA . CA = V.C’A ⇒ 100 . 70 = 300 . C’A ⇒ C’A ≈ 23,3 g/L
para o KCl: VB . CB = V.C’B ⇒ 200 . 40 = 300 . C’B ⇒ C’B ≈ 26,6 g/L
Exemplo:
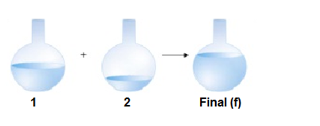
Frasco 1:
n= 0,1 mol de NaCl
V = 200 mL
Frasco 2:
M = 0,2 mol de CaCl2
V = 300 mL
Qual a concentração final dos íons Na+, Ca+2 e Cl− após misturarmos os conteúdos dos frascos 1 e 2.
Frasco 1: NaCl
NaCl → Na+ + Cl-
1mol 1mol 1mol
0,1mol 0,1mol 0,1mol
Temos então no frasco 1:
0,1 mol de Na+ e 0,1 mol de Cl-
Frasco 2: CaCl2
CaCl2 → Ca+2 + 2Cl−
1mol 1mol 2mol
0,2mol 0,2mol 0,4mol
Temos então no frasco 2:
0,2 mol de Ca+2 e 0,4 mol de Cl−
No frasco final, após a mistura de 1 e 2:
Vfinal = 200mL + 300mL = 500mL = 0,5L
Concentração final:
Para Na+
n = 0,1 mol
V = 0,5L
M = n / V(L) → M = 0,1 / 0,5 → M = 0,2 mol/L de Na+
Para Ca+2
n = 0,2 mol
V = 0,5L
M = n / V(L) → M = 0,2 / 0,5 → M = 0,4 mol.L-1 de Ca+2
Para Cl^-− (íon comum as duas soluções misturadas)
n1 + n2 = nf → 0,1 + 0,4 = 0,5 mol
V = 0,5L
M = n / V(L) → M = 0,5 / 0,5 → M = 1 mol/L de Cl−
Mistura de soluções com reação química
Os casos mais comuns ocorrem quando juntamos um ácido uma base, ou um oxidante e um redutor; ou soluções de dois sais que reagem entre si. Quando há reação química, podem ocorrer duas situações:
1ª. Os dois solutos estão em quantidades exatas para reagir (proporção estequiométrica);
2ª. Caso contrário, sobrará um excesso do primeiro ou do segundo soluto. A seguir exemplificamos esses dois casos.
1º exemplo:
Quando os solutos estão em proporção estequiométrica:
Juntando-se 300mL de HCl 0,4 molar com 200mL de NaOH 0,6 molar, pergunta-se quais serão as molaridades da solução FINAL com respeito:
a) ao ácido;
b) à base;
c) ao sal formado.
Resolução: Neste exemplo, fala-se de uma mistura de uma solução de HCl com outra, de NaOH. Esses dois solutos reagem de acordo com a equação:
HCl + NaOH --> NaCl + H2O
Pode haver excesso de HCl ou de NaOH, o que somente poderemos determinar por meio do cálculo estequiométrico. O cálculo estequiométrico fica mais fácil se for efetuado com o auxílio das quantidades de mols dos reagentes e dos produtos da reação. Ora, a quantidade de mols (n) de cada soluto pode ser calculada de duas maneiras:
1ª) n = m/MM , em que: m é a massa (gramas), e MM , a massa molar (g/mol)
2ª) n = M.V ,em que :M é a molaridade da solução(mol/L),e V ,o seu volume (L).
Como na questão foi dada a molaridade das soluções, calculamos da seguinte forma:
Para o ácido: n = M.V -> n = 0,4 mol/L * 0,3 L -> n = 0,12 mol de HCl
Para a base: n = M.V -> n = 0,6 mol/L * 0,2 L -> n = 0,12 mol de NaOH
Como podemos observar as proporções ácido-base da reação (1:1) tendo 0,12 mol de cada chegamos a conclusão que todo o ácido e toda a base reagiram por completo sem excessos. E se a base e o ácido reagiram por completo, eles se transforam todo no sal (NaCl) suas concentrações finais são iguais a zero. Quanto ao sal, podemos dizer que:
Já que a proporção da reação é de 1:1:1, formam-se 0,12mol desse sal, dissolvido em água, na solução final, cujo volume é: 300 mL + 200 mL = 500 mL. Portanto, a molaridade do NaCl será:
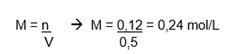
2º exemplo:
Quando os solutos não estão em proporção estequiométrica:
Juntando-se 300mL de HCl 0,4 molar com 200mL de NaOH 0,8 molar, pergunta-se quais serão as molaridades da solução FINAL com respeito:
a) ao ácido;
b) à base;
c) ao sal formado.
Resolução: Seguindo o mesmo raciocínio que fizemos para resolver o exemplo anterior, calculamos as quantidades, em mols, dos solutos iniciais:
Para o ácido: n = M.V -> n = 0,4 mol/L * 0,3 L -> n = 0,12 mol de HCl
Para a base: n = M.V -> n = 0,8 mol/L * 0,2 L -> n = 0,16 mol de NaOH
Perceba que a proporção de numero de mol dessa vez não está de 1:1, temos um excesso de base. Todo o ácido irá ser consumido, porém 0,4 mol da base irão sobrar no fim da reação (0,16 NaOH - 0,12 HCl = 0,4 NaOH).

Titulação
Quando se precisa saber a concentração em mol/L de alguma solução, costuma-se usar uma técnica de análise volumétrica chamada titulação, ou, titulação ácido-base. Esse método é feito colocando-se para reagir uma solução a qual se sabe a concentração, que é denominada de titulante, com a solução a qual não se sabe a concentração, que é denominada de titulado. Uma dessas soluções é uma base, enquanto a outra é um ácido, logo elas reagem formando sal e água. O pH costuma ficar neutro ou próximo disso, o que equivale a um pH igual a 7. É preciso saber equacionar esse tipo de reação para os cálculos usados na titulação, conforme será mostrado mais adiante.
Com a adição de um indicador ácido-base(fenoftaleína, azul de bromotimol, alaranjado de metila…), observa-se quando a reação se completa, atingindo o ponto de viragem. É possível saber quando isso ocorre e parar a reação, porque a cor da solução sofre uma mudança brusca na presença de um indicador ácido-base, em virtude da variada do pH. No entanto, embora o ponto de equivalência indique o término da titulação, nem sempre os volumes das soluções que são utilizadas resultam em uma solução final neutra, com pH igual a 7.
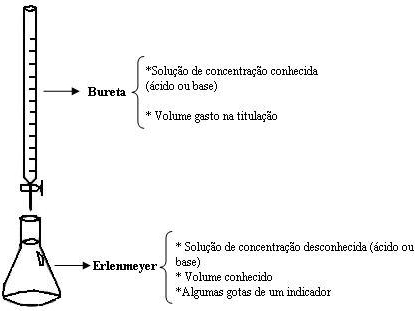
Veja o passo a passo de como costuma ser feita uma titulação ácido-base em laboratório:
• Com o auxílio de uma pipeta, transfere-se um volume conhecido do titulado para um erlenmeyer.
• Adicionam-se poucas gotas de algum indicador ácido-base, como a fenolftaleína, ao titulado;
• Completa-se o volume de uma bureta com a solução titulante.
• Inicia-se a reação abrindo vagarosamente a torneira da bureta para que, gota a gota, o titulante caia sobre o titulado. Enquanto uma das mãos permanece sobre a torneira (para que, se for preciso, ela seja fechada imediatamente), a outra mão fica agitando o erlenmeyer para que a reação ocorra em toda a extensão da solução que está sendo titulada.
• Quando a cor do titulado muda bruscamente, fecha-se a torneira da bureta, pois a reação se completou.
• Por exemplo, se o indicador usado foi a fenolftaleína e o titulado era inicialmente uma solução de ácido clorídrico (HCl), a solução com o indicador estava incolor. Mas, no ponto de viragem, a solução passa para a cor rosa.
Agora, basta ler o volume de titulante que foi necessário para neutralizar o titulado, equacionar a reação que ocorreu e, com os outros dados em mãos, fazer as contas para descobrir a concentração do titulado.
Esquema de uma titulação:
Exemplo: 20 mL de uma solução de NaOH de concentração desconhecida foi titulada com uma solução de HCl de concentração igual a 0,5 mol/L. Sabendo que 40 mL de ácido foi necessária para que a titulação seja completa, qual a concentração da solução básica?
Xácido . Mácido . Vácido = Xbase . Mbase . Vbase
1 . 40 mL . 0,5 mol/L = 1 . Mbase . 20 mL
Mbase = 1 mol/L de base