Pressão Máxima de vapor em um mesmo líquido
Pressão Máxima de Vapor em líquidos diferentes
Pressão de Vapor - Tonoscopia
Fórmula quantitativa de Propriedades Coligativas
Exercício de Propriedades Coligativas – 1/3
Exercício de Propriedades Coligativas – 2/3
Exercício de Propriedades Coligativas – 3/3
Propriedades coligativas: pressão de vapor e tonoscopia
Quando adicionamos soluto não volátil a um solvente, o sistema resultante passa a ter um conjunto específico de propriedades diferentes das do composto puro inicial, as quais chamamos de propriedades coligativas.
Mas o que são solutos não voláteis (SNV)?
Volatilidade é uma propriedade física de líquidos que pode ser definida como a capacidade de ele virar vapor. É perceptível para nós que a acetona e o álcool etílico viram vapor com facilidade muito maior que a da água, por isso dizemos que são mais voláteis.
Sendo assim, SNVs são aqueles que não viram vapor ou gás com facilidade, à temperatura ambiente. Os sais e as bases cujos cátions são metais (hidróxidos metálicos), por exemplo, são solutos não voláteis.
É muito importante saber que, quanto maior for o número de espécies dissolvidas no sistema, mais intensa será a forma como essas propriedades irão ocorrer.
Obs: espécie é um termo genérico para designar todo e qualquer tipo de substância ou partícula presente na natureza, bem como nas diversas reações que nela ocorrem. Por exemplo, um recipiente com NaCl dissolvido em água não possui uma só espécie dissolvida, embora possua apenas um composto químico dissolvido. Na verdade, este sistema possui duas espécies dissolvidas: um Na+ e um Cl-.
Veja:
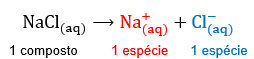
Antes de estudarmos cada propriedade coligativa, é importante sabermos distinguir dois tipos de solução:
a) Solução iônica: obtemos ao dissolvermos um composto iônico no solvente. Assim, as partículas presentes serão íons. Exemplos: NaCl, Ca(OH)2, NH4Cl, etc.
b) Solução molecular: obtemos ao dissolvermos um composto molecular/covalente no solvente. Assim, as partículas presentes serão moléculas. Exemplos: C6H12O6, C12H22O11, etc.
A diferença de comportamento de cada um desses tipos de soluto influi nos efeitos coligativos, uma vez que compostos iônicos se dissociam no solvente, gerando mais espécies dissolvidas do que os compostos moleculares, que não se dissociam.
Tomemos como exemplos o NaCl e a C12H22O11:
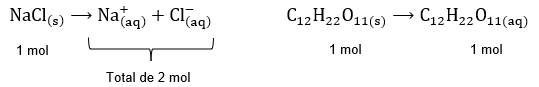
Dessa forma, no caso ilustrado, as propriedades coligativas na solução de cloreto de sódio serão mais intensas do que na solução de sacarose.
Obs: Os ácidos, embora sejam compostos moleculares e não sofram dissociação iônica, eles sofrem ionização em meio aquoso. Ou seja, o composto não é iônico, mas em água ele gera íons.
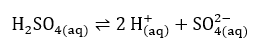
A propriedades coligativas:
I - Pressão de vapor
Você já parou pra pensar porque a poça de água da chuva evapora, ou as roupas do varal secam?! Como isso pode acontecer se a temperatura de ebulição da água é 100ºC?! As moléculas de qualquer líquido estão sempre em movimento; algumas moléculas, porém, têm velocidades maiores do que outras e, por isso, conseguem “escapar” do líquido, passando para a atmosfera. É assim que se explica o fenômeno da evaporação da água da poça d‘água e da secagem de roupa no varal.
Observe o experimento abaixo:
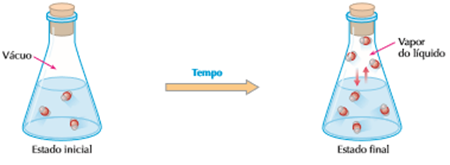
Assim como no caso da poça d’água, as partículas no recipiente também “escapam” do líquido e passam para a fase de vapor. mas já que o recipiente já está fechado, “não têm para onde fugir”. Na fase gasosa, as partículas tem uma maior velocidade, e chocam-se entre si e contra as paredes do recipiente e algumas retornam à fase líquida. Depois de um certo tempo, o número de partículas que “escapam” se iguala ao número de partículas que retornam ao líquido, por unidade de tempo; então, a evaporação e a condensação continuam acontecendo e a velocidade de evaporação do líquido se torna igual à velocidade de condensação de seus vapores , chamamos isso de equilíbrio dinâmico.
Assim, surge a definição:
Pressão ou (tensão) máxima de vapor de um líquido é a pressão exercida por seus vapores quando estes estão em equilíbrio dinâmico com o líquido.
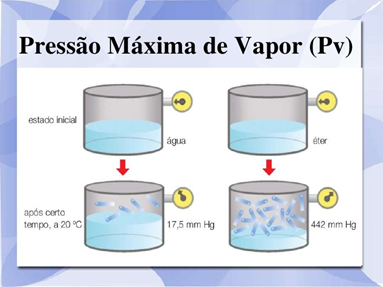
É bom lembrar também que quanto maior for a pressão máxima de vapor de um líquido maior será sua tendência a evaporar ou dizemos, ainda, que o líquido é mais volátil (maior volatilidade).
Influências na pressão de vapor:
1)Temperatura → Aumentando-se a temperatura, as partículas do líquido se agitam mais; e, em consequência, o líquido e vapor a mais intensamente, produzindo então maior pressão de vapor.
2)Natureza do liquido → Líquidos mais voláteis do que a água, como o álcool comum, o éter comum, etc, evaporam-se mais intensamente, resultando maiores pressões máximas de vapor à mesma temperatura. A maior ou menor pressão de vapor de um líquido depende das forças de coesão entre suas moléculas. Forças intensas, como as pontes de hidrogênio, dificultam essa evaporação e, em consequência, tornam o líquido menos volátil, isto é, com menor pressão de vapor, Forças pouco intensas, como as de Van der Waals, por serem de menor intensidade, tornam o líquido mais volátil, é o caso do éter comum.
3)Quantidade do liquido e vapor presente → É interessante notar que a pressão máxima de vapor de um líquido, a uma dada temperatura, não depende das quantidades de líquido e de vapor presentes, pois isso é uma característica que depende da substância e não da quantidade dela no recipiente
Matemáticamente falando, nós temos a seguinte expessão para pressão de vapor:
(Psolução – Plíquido puro) / Plíquido = kt . W
W = nsoluto/msolvente
Obs. A massa do solvente deve estar em kg
Onde,
kt = constante tonoscópica molal
n = número de moles
W = nsoluto/ msolvente (em kg)