Deslocamento de equilíbrio
Rendimento
Reação da amônia – P x %NH3
Kc
Grau de dissociação em % de AB
Kc e Kp
Equilíbrio químico
Existem reações onde os reagentes e os produtos estão em constante reação em processos opostos, tais reação chamamos de reações reversíveis, que quando com a mesma velocidade de reação em ambos os sentidos atingem o equilíbrio químico.
Exemplo:
N2(g) + 3 H2(g) ⇌ 2 NH3(g)
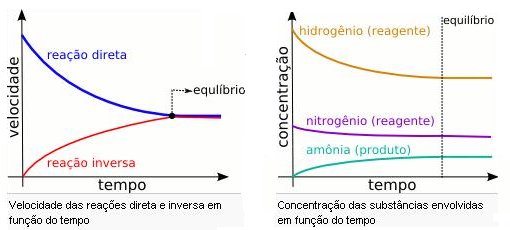
A reação representada acima de produção da amônia(NH3) é uma reação reversível, onde a todo momento temos H2 e N2 reagindo para formar NH3, mas também temos a amônia(NH3) se decompondo e voltando a se tornar H2 e N2. Quando estas velocidades de reação em ambos os sentidos se igualam, dizemos que alcançamos o equilíbrio químico.
Gráfico de equilíbrio químico
Psiu!!
No momento em que as velocidades ou concentração se tornam constantes atingimos o equilíbrio químico da reação.
Expressão para Equilíbrio Químico e a constante Kc
Em 1886, químicos noruegueses descobriram existir uma relação entre a concentração dos reagentes e dos produtos em equilíbrio químico, excluindo os reagentes e produtos no estado físico sólido. Essa relação foi chamada de Lei de Ação das massas, onde para uma reação reversível genérica:
aA + bB ⇌ cC + dD
Temos que a relação entre as concentrações será:
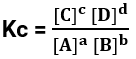
Onde Kc é a nossa constante de equilíbrio.
Psiu!!
Quanto maior o valor de Kc, maior a tendência de ocorrer a reação no sentido de formação dos produtos. Quanto menor o valor de Kc, maior a tendência de ocorrer a reação no sentido de formação dos reagentes.
Expressão para Equilíbrio Químico e a constante Kp
Com relação aos gases participantes do equilíbrio, podemos gerar uma relação entre reagentes e produtos através de suas pressões parciais, já que essas pressões são proporcionais as suas molaridades.
Exemplo:
Para a reação: aA + bB ⇌ cC + dD
Temos que a relação entre as pressões parciais será:
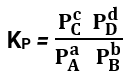
Onde Kp é a nossa constante de equilíbrio em relação a pressão parcial.