Célula eletroquímica de LiCoO2(s) e grafite.
Análise de um experimento de eletroquímica.
DDP de uma célula de Magnésio e Cobre.
Eletrólise de células no tratamento do câncer
Eletrólise de uma solução de NaCl
Desgaste de uma pilha de Magnésio.
Uso da eletrólise na produção de Alumínio
Metal de sacrifício de uma reação eletroquímica
A Eletroquímica é a parte da química que estuda a produção de energia elétrica a partir de reações que ocorrem com transferência de elétrons: as reações de oxirredução, que já conhecemos. Na eletroquímica estudaremos dois processos, as pilhas e a eletrólise.
Pilha
O primeiro processo eletroquímico – o que estudaremos neste material – é a pilha (esse processo ocorre tanto nas conhecidas pilhas como nas baterias). Ela se caracteriza pela formação de corrente elétrica a partir de uma reação espontânea de oxirredução. Nesta reação, uma das espécies químicas utilizadas sofre redução – isto é, recebe elétrons – e a outra sofre oxidação – isto é, perde elétrons. O que se faz é forçar esses elétrons transferidos a transitarem por um fio, um circuito externo.
Cada espécie possui um potencial de oxidação (Eoxi), que é a sua tendência em perder elétrons (oxidar) e um potencial de redução (Ered), que é a sua tendência em ganhar elétrons (reduzir).
O potencial de oxidação de uma espécie tem sempre o mesmo módulo (valor) do seu potencial de redução, mas com sinal oposto. Sendo assim, se o Eoxi de X é n, seu Ered é –n.
A espécie que possuir maior potencial de redução (ou seja, menor potencial de oxidação) será a que sofrerá redução. A que possuir menor potencial de redução (ou seja, maior potencial de oxidação) será a que sofrerá oxidação.
O que força os elétrons a transitarem da espécie redutora (ou seja, a que faz a outra reduzir, portanto, a que é oxidada) para a espécie oxidante (ou seja, a que faz a outra oxidar, portanto, a que é reduzida) é a diferença entre o potencial que a primeira tem de oxidar (Eoxi) e o potencial que a última tem de reduzir (Ered). Essa diferença chamamos de diferença de potencial (ddp ou ΔE) ou força eletromotriz (fem), porquanto força a movimentação dos elétrons. Sua unidade é volt (V). Se liga só nas duas maneiras com que podemos calculá-la:
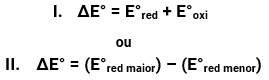
Onde:
E°red = potencial de redução de quem se reduz;
E°oxi = potencial de oxidação de quem se oxida;
E°red maior = maior potencial de redução, entre as espécies envolvidas;
E°red menor = menor potencial de redução, entre as espécies envolvidas;
Como a reação redox na pilha ocorre de maneira espontânea, a ddp ou ΔE° sempre terá valor positivo.
Eletrólise
Eletrólise, em primeira análise, é o processo que decompõe um eletrólito através da eletricidade. O sufixo “lise” significa “quebra”, “decomposição”, “ruptura”, assim como em hidrólise (decomposição de um composto químico pela água), em pirólise (decomposição de um composto químico pelo fogo ou altas temperaturas), em hemólise (quebra ou ruptura da hemácia), etc.
A eletrólise consiste no processo eletroquímico que, ao contrário da pilha, converte energia elétrica em energia química. Como assim? Simples, usa-se a eletricidade – corrente elétrica – para promover uma reação de oxirredução, por meio da qual se produzem substâncias químicas a partir de outras. Vejamos suas principais características:
· Ocorre em sistemas líquidos: eletrólitos fundidos, quando for eletrólise ígnea, ou em solução aquosa, quando for eletrólise aquosa.
· Ao contrário da pilha novamente, ocorre de maneira não espontânea, ou seja, é necessário um gerador (pilha) para forçar a reação redox a ocorrer, forçar as espécies envolvidas a reduzirem ou oxidarem. Isso já nos diz algo muito importante: se a espécie que se reduz não o faz naturalmente, é porque seu potencial de redução não é superior ao da outra; da mesma maneira, se a espécie que se oxida não o faz naturalmente, é porque seu potencial de oxidação não é superior ao da outra. Logo, na eletrólise:

Onde:
E°red = potencial de redução de quem reduziu;
E°oxi = potencial de oxidação de quem oxidou;
E°red menor = potencial de redução de quem reduziu, pois, na eletrólise, quem reduz é quem tem menor potencial de redução;
E°red maior = potencial de redução de quem oxidou, pois, na eletrólise, quem oxida é quem tem maior potencial de redução.